Réponses aux questions des professionnels de santé sur l’innocuité des vaccins contre la COVID-19
Cette foire aux questions vise à fournir des réponses claires et exhaustives aux questions courantes sur les vaccins contre la COVID-19. La page s’adresse aux professionnel·les de santé qui cherchent des outils pour mieux expliquer des informations techniques sur la vaccination à leurs patient·es. Les réponses sont présentées en deux parties : des messages essentiels en style clair et simple sur la question en cause, et un résumé plus technique qui aborde en profondeur les preuves à l’appui.
Si vous avez une question, contactez-nous et nous verrons s’il faut l’ajouter à la liste.
Plusieurs langues : Cette page est également disponible en anglais, en chinois, en arabe, et en espagnol. (le dernière mise à jour: le 16 décembre 2021)
Avis de non-responsabilité : Comme la science et les directives sanitaires sur les vaccins contre la COVID-19 évoluent rapidement, rien ne garantit que les informations sur cette page sont complètes et à jour. Toutefois, si d’autres questions sont portées à notre attention ou d’autres informations deviennent disponibles, les réponses seront mises à jour, et de nouvelles réponses seront publiées. Les questions et leurs réponses sont hébergées sur la présente page et comportent des renvois vers d’autres sites.
Réponses aux questions sur l’innocuité du vaccin contre la COVID-19
GÉNÉRALITÉS
Un vaccin contre la COVID-19 est-il nécessaire après une infection à la COVID-19?
La vaccination contre la COVID-19 après une infection est vivement recommandée.
Ce qu’il faut savoir
- Il est vivement recommandé aux personnes ayant été infectées par la COVID-19 de recevoir une dose de vaccin contre la COVID-19.
- L’immunité protectrice conférée par une infection à la COVID-19 n’est pas suffisante pour protéger contre une réinfection à la COVID-19, ni contre la maladie grave.
- Les recommandations quant au délai d’attente avant de recevoir une dose de vaccin contre la COVID-19 après une infection à la COVID-19 sont contradictoires.
- L’ « immunité hybride » contre la COVID-19 (l’immunité résultant de l’infection et de la vaccination) offre une meilleure protection que l’infection à elle seule
Recommandations sur la vaccination contre la COVID-19 après une infection
Avec le nombre croissant de personnes ayant contracté la COVID-19 au Canada et ailleurs dans le monde, les gens se demandent si et quand ils devraient recevoir des vaccins contre la COVID-19 après une infection à la COVID.
À l’heure actuelle, les principales autorités sanitaires du monde s’entendent pour recommander vivement aux personnes ayant eu une infection à la COVID-19 de recevoir une dose de vaccin (initiale ou de rappel) contre la COVID-19. Le délai d’attente recommandé après une infection à la COVID-19 varie :
- Le Comité consultatif national de l’immunisation (CCNI) du Canada recommande d’attendre 6 mois avant de recevoir un vaccin contre la COVID après une infection à la COVID-19.
- L’Organisation mondiale de la santé (OMS) recommande aussi d’attendre 6 mois avant de se faire vacciner après une infection à la COVID-19.
- Les Centers for Disease Control and Prevention (CDC) des États-Unis recommandent d’attendre seulement 3 mois.
Ces différences pourraient dépendre de la priorité accordée à une protection rapide par opposition à une protection durable. Il est vrai qu’un vaccin contre la COVID-19 reçu seulement 3 mois après une infection à la COVID-19 protège une personne beaucoup plus tôt. Par contre, se faire vacciner après un délai de 6 mois peut conférer une immunité protectrice de plus longue durée contre le virus. Malheureusement, nous n’avons pas encore d’études scientifiques pour déterminer le moment optimal de la vaccination contre la COVID-19 après une infection confirmée à la COVID-19. Néanmoins, les personnes les plus à risque de contracter la forme grave de la COVID-19 devraient recevoir une dose de vaccin contre la COVID-19 aussi rapidement que possible, selon leur risque particulier et le contexte. Cela signifie que pour certaines personnes, le délai de 3 mois peut être la meilleure option, tandis que pour d’autres, il vaut mieux attendre 6 mois.
L’immunité protectrice après une infection à la COVID-19
L’infection naturelle n’est pas la façon idéale d’acquérir une protection durable contre la COVID-19. Elle confère une certaine immunité protectrice, mais ne protège pas contre tous les variants existants du virus. Il y eu des cas de deuxième ou même de troisième infection à la COVID-19. La force de l’immunité protectrice acquise à la suite d’une infection à la COVID-19 dépend du variant de la COVID-19 ayant causé l’infection, du degré d’infection et du fait que la personne ait reçu ou non une dose de vaccin contre la COVID-19 avant d’être infectée (y compris le type de vaccin et la date à laquelle il a été reçu).
L’immunité protectrice acquise à la suite d’une infection à la COVID-19 ne protège pas nécessairement contre une deuxième infection, et elle n’empêche pas une personne vaccinée d’être infectée (ce que les médecins appellent une « infection postvaccinale »). En réalité, l’immunité protectrice acquise à la suite d’une infection, lorsqu’elle est combinée à la vaccination (« immunité hybride ») offre une meilleure protection que l’infection à elle seule.
Qu’est-ce qu’un variant de la COVID-19?
Les virus, comme celui qui cause la COVID-19, changent rapidement avec le temps en accumulant des mutations dans leur code génétique. Ces mutations peuvent changer la facilité de propagation du virus, la sévérité de la maladie et l’efficacité des vaccins actuels. Les scientifiques suivent les variants de la COVID-19 dans le monde entier pour mieux comprendre comment la maladie évolue.
Complément d’information pour les prestataires de soins de santé
Voici d’autres éléments à considérer pour savoir quand offrir un vaccin contre la COVID-19 après une infection à la COVID-19 attestée. Il faut évaluer chaque patient ou patiente d’après son risque individuel. Plusieurs facteurs entrent en jeu lorsqu’il s’agit de décider quand une dose de vaccin contre la COVID-19 devrait être administrée après une infection confirmée à la COVID-19 :
- L’âge de la personne
- Si la personne est immunodéprimée (en raison d’une maladie ou de médicaments)
- La date de la dernière dose de vaccin contre la COVID-19 qu’elle a reçue
- Son risque d’exposition, par exemple si le taux d’infection à la COVID est actuellement élevé dans sa communauté
- Si elle est en contact avec une ou plusieurs personnes dont le risque d’infection grave à la COVID-19 est élevé
- La facilité d’accès de la personne aux vaccins contre la COVID
Références
Amirthalingam G., Bernal JL, Andrews NJ, Whitaker H, Gower C, Stowe J, et al. Serological responses and vaccine effectiveness for extended COVID-19 vaccine schedules in England. Nature Communications 10 décembre 2021, 12(1):7217. https://doi.org/10.1038/s41467-021-27410-5
Hulme WJ, Williamson EJ, Horne E, Green A, Nab L, Keogh R, et al. Effectiveness of BNT162b2 booster doses in England: an observational study in OpenSAFELY -TPP. medRxiv 6 juin 2022. https://doi.org/10.1101/2022.06.06.22276026
Ireland G, Whitaker H, Ladhani SN, Baawuah F, Subbarao V, Linley E, et al. Serological responses to COVID-19 booster vaccine in England. medRxiv 24 novembre 2021. https://doi.org/10.1101/2021.11.22.21266692
Comité consultatif national de l’immunisation (CCNI). Recommandations sur l’utilisation des vaccins à ARNm bivalents contre la COVID-19 contenant le variant Omicron. Déclaration du comité consultatif (DCC); 1er septembre 2022. https://www.canada.ca/content/dam/phac-aspc/documents/services/immunization/national-advisory-committee-on-immunization-naci/recommandations-utilisation-vaccins-arnm-bivalents-contre-covid-19-contenant-variant-omicron.pdf
Shaheen NA, Sambas R, Alenezi M, Alharbi NK, et al. COVID-19 reinfection: a multicenter retrospective study in Saudi Arabia. Ann Thorac Med avril-juin 2022, 17(2):81-86. doi: 10.4103/atm.atm_74_22
Skowronski DM, Setayeshgar S, Febriani Y, Ouakki M, et al. Two-dose SARS-CoV-2 vaccine effectiveness with mixed schedules and extended dosing intervals: test-negative design studies from British Columbia and Quebec, Canada. medRxiv 26 octobre 2021. doi: 10.1101/2021.10.26.21265397
Organisation mondiale de la santé (OMS). Interim statement on hybrid immunity and increasing population seroprevalence rates; 1er juin 2022. https://www.who.int/news/item/01-06-2022-interim-statement-on-hybrid-immunity-and-increasing-population-seroprevalence-rates
Les vaccins à ARNm peuvent-ils « génétiquement modifier » les humains?
Les vaccins à ARNm ne peuvent pas apporter de changements à l’ADN humain.
Ce qu’il faut savoir
- Le vaccin à ARNm contre la COVID-19 ne peut pas changer l’ADN humain
- Le vaccin à ARNm contre la COVID-19 n’est pas un vaccin à virus vivant
- Le vaccin à ARNm contre la COVID-19 apprend au système immunitaire à repérer le virus afin de le combattre
- Le vaccin à ARNm contre la COVID-19 ne crée rien de nocif pour l’organisme
- L’ARNm et la protéine S sont détruits naturellement une fois leur tâche accomplie
Comment fonctionnent les vaccins à ARNm contre la COVID-19
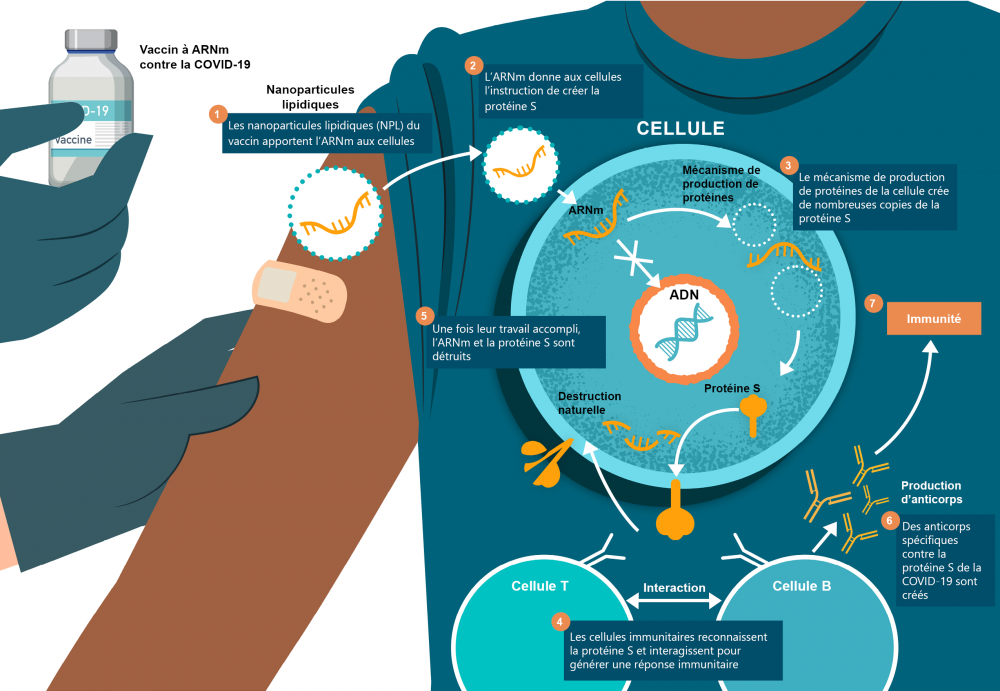
L’ARN messager—également appelé ARNm—donne aux cellules les instructions nécessaires pour combattre le virus qui cause la COVID-19. Ces instructions disent aux cellules de produire une partie inoffensive du virus, en l’occurrence ce qu’on appelle la « protéine S » (protéine spike). Cette même protéine se retrouve naturellement sur l’enveloppe extérieure du virus de la COVID-19. Le vaccin à ARNm ne donne pas d’instructions de production du virus entier.
En donnant aux cellules l’instruction de produire la protéine S, le vaccin à ARNm apprend aux cellules immunitaires à le reconnaître comme un corps étranger à l’organisme. Cela active les cellules immunitaires. Celles-ci interagiront avec d’autres pour générer une réaction de lutte contre ce que le système immunitaire perçoit comme étant une infection. Le système immunitaire se rappellera comment reconnaître le virus pour mieux protéger l’organisme contre toute infection future par la COVID-19.
Les avantages de la vaccination contre la COVID-19
Les vaccins contre la COVID-19 préparent l’organisme à combattre une infection par la COVID s’il est exposé au vrai virus plus tard. L’avantage de la vaccination est qu’elle protège contre le virus sans exposer l’organisme au danger possible de contracter la COVID-19.
Complément d’information pour les fournisseurs de soins de santé
Les vaccins à ARNm contre la COVID-19 ne sont pas des vaccins à virus vivant. Ils contiennent plutôt des parties synthétiques d’ARN messager encapsulées dans une nanoparticule lipidique (NPL) artificielle. La NPL permet d’apporter l’ARNm directement dans la cellule hôte et produit un effet stabilisant et adjuvant. Par conséquent, ces vaccins n’ont pas besoin d’un adjuvant supplémentaire pour renforcer leur efficacité potentielle.
Une fois à l’intérieur de la cellule hôte du receveur humain, l’ARNm n’entre pas dans le noyau, ne s’intègre pas à l’ADN humain et n’apporte aucune modification à l’ADN.
Le vaccin à ARNm contre la COVID-19 permet au système immunitaire de mieux préparer le receveur contre une future infection par la COVID-19. Il donne aux cellules humaines des instructions pour qu’elles fabriquent la protéine S présente à la surface du virus de la COVID-19. Une fois la protéine S fabriquée, elle se retrouve à la surface de la cellule qui l’a fabriquée. Le système immunitaire reconnaît ensuite que la protéine n’appartient pas à la cellule et active les cellules immunitaires pour qu’elles produisent des anticorps spécifiques. Les lymphocytes B et T interviennent dans cette réponse. C’est la même réponse que celle qui se produit durant une infection naturelle par la COVID-19. Le système immunitaire du receveur est ainsi entraîné à réagir à une infection future par la COVID-19.
Après que la protéine S est fabriquée et présente à la surface des cellules, l’ARNm et la protéine S se dégradent naturellement quelques jours après l’injection. L’ARNm ne se réplique pas et finit par disparaître.
Références
Centres for Disease Control and Prevention. Understanding mRNA COVID-19 vaccines. 23 novembre 2020. Consulté le 14 décembre 2020 dans https://www.cdc.gov/coronavirus/2019-ncov/vaccines/different-vaccines/mrna.html.
Zhang C, Maruggi G, Shan H, Li J. Advances in mRNA vaccines for infectious diseases. Front Immunol 2019; 10: 594. doi: 10.3389/fimmu.2019.00594.
Schlake T, Thess A, Fotin-Mleczek M, Kallen KJ. Developing mRNA-vaccine technologies. RNA Biol 2012; 9(11): 1319-1330. doi:10.4161/rna.22269
Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines – A new era in vaccinology. Nat Rev Drug Discov 2018; 17(4):261-279. doi:10.1038/nrd.2017.243.
Y a-t-il des préoccupations liées à l’innocuité des vaccins à ARNm?
Les vaccins à ARNm sont sûrs.
Ce qu’il faut savoir
- Les vaccins à ARNm ne sont pas nouveaux
- Les vaccins à ARNm ont été bien étudiés et sont sûrs
- Les vaccins à ARNm n’ont aucun effet sur l’ADN
- Les vaccins à ARNm peuvent être fabriqués rapidement et en toute sécurité
Le vaccin à ARNm contre la COVID-19 n’est pas le premier du genre
Les vaccins à ARNm ne sont pas nouveaux! En fait, ils ont été utilisés et étudiés pour le virus Zika, la rage, l’influenza et le cytomégalovirus, ainsi que pour des traitements contre le cancer. Ils font les manchettes en ce moment parce qu’ils représentent une énorme avancée dans le domaine vaccinal. Contrairement aux autres vaccins, les vaccins à ARNm n’ont pas besoin d’adjuvants—des produits chimiques qui rendent les vaccins plus efficaces—pour accomplir leur tâche. Cela veut dire que les vaccins à ARNm ne risquent pas de provoquer des réactions non désirées après leur injection. Ils ont aussi beaucoup attiré l’attention en raison des avantages qu’ils ont procurés durant la pandémie actuelle de COVID-19.
Les vaccins à ARNm sont sûrs et efficaces
L’utilisation d’ARNm dans les vaccins est un moyen sûr et efficace d’entraîner les cellules immunitaires de l’organisme à combattre les virus. Cela apprend au système immunitaire à reconnaître spécifiquement et à combattre ce qui n’appartient pas à l’organisme.
De plus, les vaccins à ARNm peuvent être fabriqués rapidement. À titre de comparaison, la production d’autres types de vaccins prend d’habitude plusieurs mois. Cela a représenté un grand avantage durant la pandémie de COVID-19.
L’ARNm a tendance à être fragile; il faut l’entreposer et le manipuler avec beaucoup de soin. C’est pourquoi les vaccins à ARNm doivent être gardés congelés et utilisés peu après leur décongélation.
Complément d’information pour les fournisseurs de soins de santé
Les vaccins à ARNm ont déjà été étudiés pour la vaccination contre le virus Zika, la rage, l’influenza et le cytomégalovirus (CMV). Ils ont aussi été étudiés dans la recherche sur le cancer comme moyen d’amener le système immunitaire à cibler des types particuliers de cellules cancéreuses. L’ARNm est une solution très séduisante contre les maladies, car il permet à n’importe quelle protéine d’être exprimée par le corps humain à partir d’ARNm artificiel, synthétique. Cela permet une approche plus ciblée que celle de certains vaccins dépendant d’adjuvants, qui génèrent une réponse immunitaire plus générale. Il y a d’autres avantages à utiliser les vaccins à ARNm, mais il reste encore à en aborder certaines des contraintes de base.
Avantages
- L’ARNm est un vecteur sûr pour un vaccin, car il est transitoire (il se décompose métaboliquement en quelques jours) et il est porteur d’informations (des instructions de production de protéines) qui n’interagissent pas avec l’ADN de la personne vaccinée. De plus, l’ARNm est non réplicatif, c’est-à-dire incapable de produire d’autres copies de lui-même.
- Bientôt, la technique de l’ARNm pourrait potentiellement permettre à un seul vaccin de conférer une protection contre plusieurs maladies. Cela réduirait le nombre d’injections nécessaires et pourrait peut-être aussi accroître les taux de vaccination globaux et donc l’immunité collective.
- Les processus de fabrication d’ARNm et de formulation des nanoparticules lipidiques (NPL) sont rapides et hautement extensibles, ce qui permet la production rapide et sûre d’un volume élevé de doses de vaccins. Une production rapide permet de mieux réagir aux éclosions virales. Par conséquent, les vaccins à ARNm conviennent à merveille à la mise au point rapide de vaccins dans le contexte d’une pandémie.
Contraintes
- En raison de la composition fragile de l’ARNm, les vaccins à ARNm doivent être entreposés et manipulés avec très grand soin pour rester stables.
Voici les exigences d’entreposage et de manipulation des vaccins approuvés contre la COVID-19 au Canada :
- Vaccin à ARNm contre la COVID-19 de Pfizer (BNT162b2) : entreposé à une température de -80 °C à -60 °C (112 °F à 76 °F). Une fois décongelé et dilué avant son administration, il doit être entreposé à une température de 2 °C à 25 °C (35 °F à 77 °F) et utilisé dans un délai de 6 heures après sa dilution.
- Vaccin à ARNm contre la COVID-19 de Moderna (ARNm-1273) : entreposé à une température de -20 °C (-4 °F) pendant une durée maximale de 6 mois. Une fois décongelé, il doit être entreposé à une température de 2 °C à 8 °C (36 °F à 46 °F) pendant une durée maximale de 30 jours au cours de sa période de conservation de 6 mois.
Références
Centres for Disease Control and Prevention. Understanding mRNA COVID-19 vaccines. 23 novembre 2020. Consulté le 14 décembre 2020 dans https://www.cdc.gov/coronavirus/2019-ncov/vaccines/different-vaccines/mrna.html.
Zhang C, Maruggi G, Shan H, Li J. Advances in mRNA vaccines for infectious diseases. Front Immunol 2019; 10: 594. doi: 10.3389/fimmu.2019.00594.
Schlake T, Thess A, Fotin-Mleczek M, Kallen KJ. Developing mRNA-vaccine technologies. RNA Biol 2012; 9(11): 1319-1330. doi:10.4161/rna.22269
Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines – A new era in vaccinology. Nat Rev Drug Discov 2018; 17(4):261-279. doi:10.1038/nrd.2017.243.
ESSAIS CLINIQUES
Comme détermine-t-on l’innocuité des vaccins?
Les vaccins sont soumis à des études rigoureuses pour en tester l’innocuité et l’efficacité potentielle.
Ce qu’il faut savoir
- Les vaccins nécessitent une preuve d’innocuité plus solide que la plupart des médicaments
- L’innocuité des vaccins est rigoureusement analysée lors d’études précliniques et d’essais cliniques
- Les vaccins contre la COVID-19 ne font pas exception et ont suivi les mêmes processus d’analyse de leur innocuité et de leur efficacité potentielle
- Les vaccins sont évalués par des organismes de réglementation gouvernementaux et des experts non gouvernementaux impartiaux avant leur approbation finale
Tous les vaccins nécessitent une preuve d’innocuité et d’efficacité
Les vaccins sont administrés à des personnes en bonne santé pour prévenir les maladies. C’est pourquoi ils nécessitent une preuve d’innocuité plus solide que la plupart des médicaments thérapeutiques. Ils sont soumis à des évaluations très rigoureuses qui font appel à des groupes de volontaires comme sujets d’épreuve avant d’être utilisés dans la population générale. À terme, les vaccins sont approuvés par des organismes de réglementation gouvernementaux et des experts non gouvernementaux comme étant sûrs et efficaces d’après les résultats de ces tests d’innocuité et d’efficacité. Les personnes qui approuvent les vaccins ne travaillent pas pour les entreprises qui les fabriquent. Si les vaccins ne respectent pas les normes d’innocuité et d’efficacité durant ces tests, ils ne sont pas approuvés.
Les vaccins sont soumis à des études précliniques et des essais cliniques
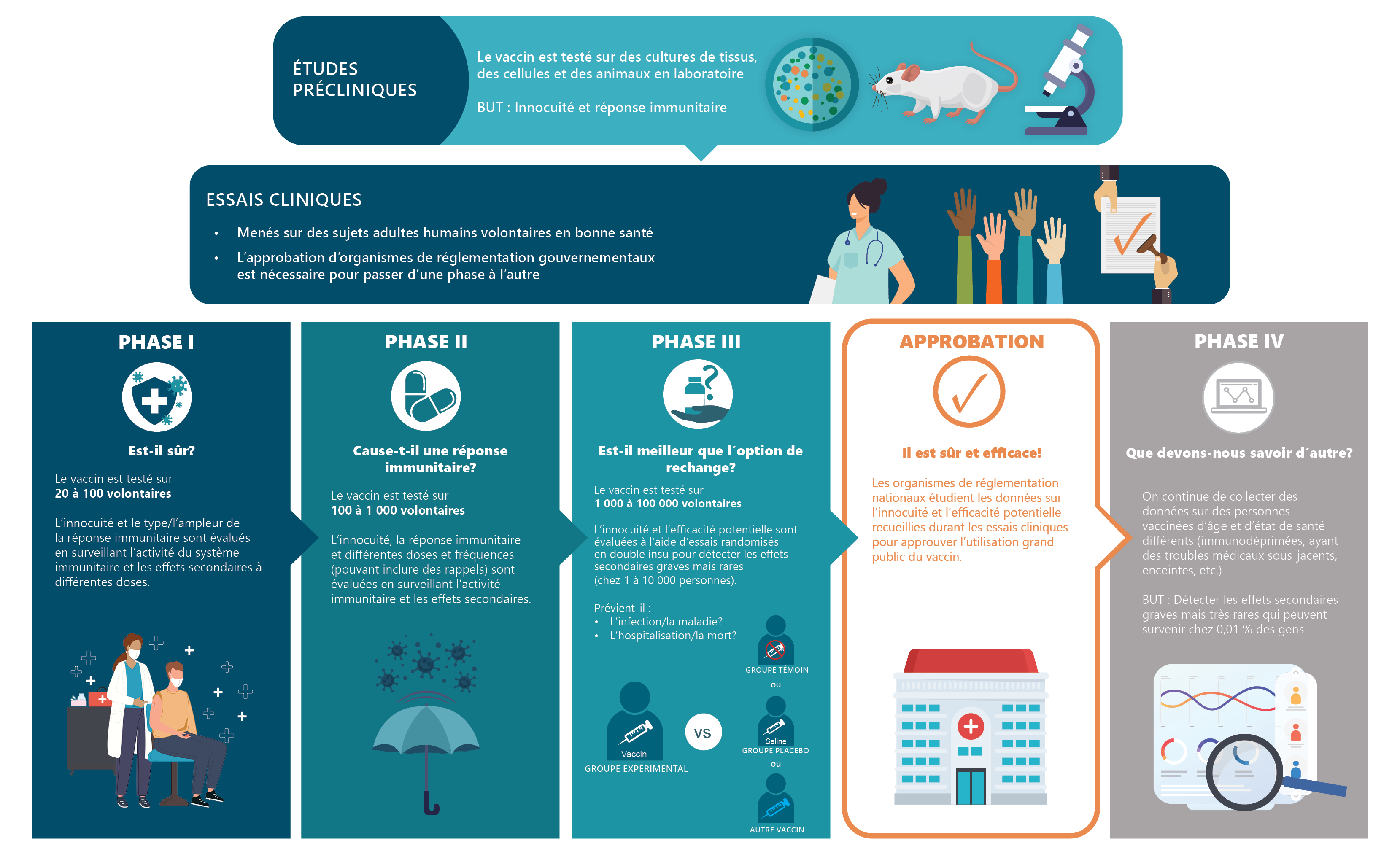
Durant les essais, les vaccins doivent montrer deux choses : qu’ils sont sûrs (ils ne causent pas de tort aux gens) et qu’ils sont efficaces (ils protègent contre un virus). Les vaccins sont évalués en quatre étapes. Un vaccin ne peut pas passer à l’étape suivante s’il n’est pas sûr.
À la première étape, celle de l’étude préclinique, le vaccin est testé en laboratoire sans faire appel à des volontaires humains. Les trois étapes suivantes sont appelées « essais cliniques », car elles impliquent des volontaires humains.
- Études précliniques : cette première étape étudie le vaccin en laboratoire à l’aide de tissus, de cellules ou d’animaux (comme des souris).
- Essais cliniques de phase I : si le vaccin réussit la première étape, il est testé sur un petit groupe de sujets adultes (environ 20 à 100 volontaires).
- Essais cliniques de phase II : si le vaccin réussit la phase I, il est testé sur un plus grand groupe de sujets adultes (des centaines de personnes).
- Essais cliniques de phase III : si le vaccin réussit la phase II, il est testé sur un groupe de sujets adultes beaucoup plus grand (de quelques milliers à des dizaines de milliers de personnes).
Les données de ces études et essais sont ensuite soumises à l’approbation d’organismes de réglementation gouvernementaux et d’experts non gouvernementaux. Ce n’est que lorsqu’un vaccin est passé par toutes ces étapes qu’il peut être approuvé pour utilisation au Canada.
Les vaccins contre la COVID-19 ne font pas exception
Un malentendu largement répandu au sujet des vaccins contre la COVID-19 est qu’ils ont été produits trop vite pour avoir réussi les étapes d’innocuité et d’efficacité potentielle nécessaires, et que l’on n’a pas collecté suffisamment de données à leur sujet pour les juger sûrs. C’est faux. Les vaccins approuvés contre la COVID-19 ont réussi tous les processus et procédures normalisés qui en ont établi l’innocuité et l’efficacité potentielle avant leur administration à la population canadienne. En outre, des millions de personnes autour du monde ont maintenant reçu des doses des vaccins contre la COVID-19 dont l’utilisation est approuvée au Canada. Cela veut dire que nous avons une grande quantité de données—beaucoup plus que pour d’autres vaccins—qui attestent de l’innocuité des vaccins à ARNm contre la COVID-19.
Complément d’information pour les fournisseurs de soins de santé
La mise au point des vaccins est soumise à une rigoureuse série de processus et de procédures scientifiques et éthiques soigneusement mis en œuvre pour assurer l’innocuité et l’efficacité potentielle des vaccins avant leur introduction dans la population. À chaque étape, les données des études et essais sont évaluées par des organismes de réglementation gouvernementaux, qui accordent l’autorisation de passer à l’étape suivante. Le déroulement de la série d’études et d’essais est le suivant :
Études précliniques : Ces études sont effectuées en laboratoire pour évaluer à la fois l’innocuité du vaccin et son immunogénicité (c.-à-d. sa capacité de produire une réponse immunitaire) à l’aide de cultures tissulaires, de cultures cellulaires et/ou de modèles animaux (p. ex. souris, furets et/ou singes).
Essais cliniques : Des essais cliniques sont effectués sur des sujets adultes humains volontaires en bonne santé en trois phases distinctes. L’approbation des organismes de réglementation gouvernementaux est exigée à chaque phase avant de passer à la suivante.
Phase I : Ces essais cliniques visent à évaluer l’innocuité du vaccin et le type et l’ampleur de la réponse immunitaire dans un petit groupe de sujets d’épreuve.
Phase II : Ces essais cliniques évaluent l’innocuité, l’immunogénicité, le dosage et le calendrier d’administration du vaccin à l’aide d’un plus grand groupe de volontaires.
Phase III : Ces essais cliniques évaluent plus avant l’innocuité et l’efficacité potentielle au moyen d’essais randomisés et à double insu; le vaccin est testé par rapport à un groupe témoin (c.-à-d. qui ne reçoit aucune injection) ou un groupe placebo (c.-à-d. qui reçoit une substance inerte, comme une injection de solution saline). Les essais cliniques de phase III permettent de détecter les effets secondaires rares trop peu fréquents pour être observés dans des groupes plus petits (p. ex. chez moins de 1 à 10 personnes sur 10 000).
D’après ces études et essais, l’innocuité du vaccin et son efficacité potentielle sont ensuite évaluées par des organismes de réglementation gouvernementaux (indépendamment des chercheurs ayant mené les études et du fabricant du vaccin) et par des experts non gouvernementaux avant que le vaccin soit approuvé pour utilisation au Canada. Les vaccins contre la COVID19 ne font pas exception et ont été soumis aux mêmes séries d’évaluations rigoureuses, même s’ils ont été produits rapidement par la technique de l’ARNm.
Références
MacDonald NE, Law BJ. Canada’s eight-component vaccine safety system: a primer for health care workers. Paediatrics & Child Health 2017; e13-16. Consulté le 28 septembre 2020 dans https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5825834/pdf/pxx073.pdf.
Centers for Disease Control and Prevention. Vaccine Testing and Approval Process. Consulté le 25 septembre 2020 dans https://www.cdc.gov/vaccines/basics/test-approve.html.
Organisation mondiale de la santé. Accelerating a safe and effective COVID-19 vaccine. Consulté le 25 septembre 2020 dans https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/accelerating-a-safe-and-effective-covid-19-vaccine.
Quelles sont les mesures utilisées pour s’assurer de l’innocuité des vaccins?
Des lois, des règlements et des lignes directrices sont utilisés pour s’assurer que les vaccins sont sûrs et efficaces.
Ce qu’il faut savoir
- Les vaccins doivent respecter des normes nationales et internationales pour être approuvés
- Au Canada, les vaccins sont approuvés par des organismes de réglementation nationaux comme Santé Canada
- Malgré l’urgence, les organismes de réglementation nationaux du Canada n’ont pris aucun raccourci avec les vaccins contre la COVID-19
- Les essais cliniques sont supervisés par des comités d’éthique de la recherche, qui s’assurent que la recherche se fait conformément à l’éthique
- Des organes internationaux supervisent les obligations réglementaires et la recherche sur des sujets humains pour en assurer l’innocuité, l’efficacité et la qualité
- La surveillance de l’innocuité des vaccins se poursuit après les essais cliniques, et elle s’effectue sur une base de permanence quand les vaccins sont utilisés régulièrement
Qui fait quoi?
Il y a des lois, des règlements et des lignes directrices à l’échelle nationale et internationale qui font en sorte qu’un vaccin est sûr et qu’il fonctionne bien. Trois types d’autorités veillent à ce que les processus qui assurent l’innocuité et l’efficacité des vaccins sont suivis.
1. Les comités de recherche institutionnelle et les comités d’éthique de la recherche. Ces organismes, appelés CRI ou CER, décident si les protocoles de recherche sur les vaccins sont conformes à l’éthique. Au Canada, tous les essais cliniques doivent être inscrits auprès d’un groupe de trois organismes sur l’éthique de la recherche, le Tri-Council Panel on Research Ethics.
Les essais cliniques doivent respecter les normes éthiques suivantes :
- Le consentement éclairé : les gens doivent être libres de faire des choix concernant leurs soins médicaux.
- La capacité de prendre des décisions : les participants des études doivent pouvoir prendre des décisions concrètes, lors de leur participation l’étude .
- La conduite d’essais : les vaccins doivent être testés en toute sécurité sur des volontaires humains, et les renseignements des participants doivent être gérés convenablement.
- L’impartialité et l’équité : les participants des études ne doivent pas assumer une part injuste du fardeau direct de la participation à la recherche, mais ils ne doivent pas non plus être injustement exclus des avantages éventuels de cette recherche.
- Le respect de la vie privée et la confidentialité : les renseignements médicaux et les données des personnes qui participent aux essais cliniques doivent être collectés, entreposés, utilisés et divulgués en protégeant la vie privée de ces participants.
- La divulgation des conflits d’intérêts : aucune considération financière ou personnelle ne doit compromettre, ou sembler compromettre, le jugement professionnel des chercheurs durant la conduite des études et la communication des résultats.
- La surveillance et les rapports sur l’innocuité : les rapports et les informations collectées au sujet des problèmes d’innocuité réels et potentiels doivent être convenablement présentés.
2. Les organismes de réglementation nationaux. Ces organismes sont chargés d’approuver les essais cliniques de la phase I à la phase II, puis à la phase III. Ils sont aussi chargés d’évaluer minutieusement les données probantes de ces essais avant d’approuver un vaccin dans leurs pays respectifs. Santé Canada, la Food and Drug Administration (FDA) des États-Unis et l’Agence européenne des médicaments (EMA) sont des exemples d’organismes de réglementation nationaux.
Chaque essai clinique doit avoir un comité de surveillance des données et de la sécurité. Ce groupe d’experts examine les données sur l’innocuité durant les essais cliniques. Son travail est d’interrompre les essais en présence de manifestations indésirables. Il a aussi le pouvoir d’arrêter complètement un essai clinique s’il le juge dangereux.
3. Des organes internationaux supervisent les études de recherche sur des sujets humains et s’assurent que les règlements visant l’innocuité, l’efficacité et la qualité sont respectés. L’Organisation mondiale de la santé (OMS) coordonne aussi des groupes d’experts-conseils qui étudient les questions de santé mondiale, donnent des conseils sur les questions d’éthique et travaillent avec les organismes de réglementation nationaux à homologuer des vaccins sûrs dans les pays à faible revenu.
La transparence est primordiale!
La transparence—le fait de permettre à d’autres de voir facilement quelles mesures sont prises et pourquoi—tout au long du processus de recherche vaccinale et d’approbation des vaccins est essentielle pour l’innocuité et pour que le public soit suffisamment informé. Cela comprend la pleine divulgation des protocoles d’essais, des données et documents techniques, des rapports d’études cliniques, des règles d’interruption et des processus décisionnels.
La pandémie de COVID-19 a créé un besoin urgent de vaccins. De telles urgences sanitaires peuvent parfois servir à accélérer le processus de réglementation et à autoriser l’utilisation d’urgence d’un vaccin. L’approbation accélérée exige la plus stricte vigilance pour que l’innocuité ne soit jamais compromise. Dans le cas de la COVID-19, les organismes de réglementation nationaux n’ont pris aucun raccourci pour approuver les vaccins.
Complément d’information pour les prestataires de soins de santé
L’innocuité des vaccins contre la COVID-19 repose sur des normes réglementaires et juridiques qui limitent les conflits d’intérêts, font respecter les normes de qualité de fabrication et rendent obligatoire la déclaration des manifestations postvaccinales indésirables (MAPI) graves. Ces normes comprennent :
- Des directives claires sur la divulgation qui empêchent les personnes pouvant avoir des conflits d’intérêts personnels et/ou professionnels de participer aux décisions.
- La transparence et l’accès libre pour ce qui est des protocoles d’essais, des données (y compris sur les composants des vaccins comme les adjuvants), des modifications et adaptations, ainsi que des processus décisionnels et de leurs justifications.
- Les modifications apportées aux essais cliniques, comme la compression des phases d’essai ou l’ajout de nouvelles étapes d’essais cliniques en raison de nouveaux constats, à condition qu’elles ne posent aucun risque supplémentaire pour les participants. Toute modification doit être communiquée immédiatement, avec justification et données/preuves à l’appui.
- Toutes les données probantes des essais cliniques et les décisions prises lors de ces essais sont indépendamment évaluées de manière impartiale. Cela inclut les recommandations des comités consultatifs et les informations sur la promotion du vaccin, afin d’aborder les conflits d’intérêts perçus.
- La puissance statistique des essais cliniques doit être suffisante pour garantir l’innocuité et l’efficacité potentielle. Par exemple, les essais cliniques de phase III peuvent passer à côté de manifestations indésirables rares mais graves si le nombre de participants est trop faible (p. ex. un taux de survenue ≥ 0,01 % et < 0,1 %). Il faut utiliser des populations nombreuses pour les essais afin de repérer les manifestations indésirables rares pouvant provoquer une morbidité (p. ex. l’intussusception avec le vaccin RotaShield).
- Il faut un contrôle médical post-approbation et une surveillance médicale active pour détecter les manifestations postvaccinales indésirables très rares mais graves, y compris des échecs vaccinaux.
- La prévention réelle de la maladie—la réduction du taux d’infections réelles par la COVID-19—plutôt que le recours à des indicateurs de substitution (des preuves indirectes d’une infection). Par exemple, on utilise souvent l’agglutination visible de globules rouges pour indiquer la fixation des anticorps aux antigènes à la surface des globules rouges. C’est ce qu’on appelle la méthode sérologique : elle indique la présence ou l’absence d’anticorps spécifiques à un agent pathogène, mais ne prouve pas qu’il y ait une infection active.
- La conduite des essais de phase III dans des endroits où la maladie est prévalente afin de représenter exactement l’exposition à la maladie et de déterminer correctement la prévention de la maladie.
- Les essais de provocation humaine—où des sujets sont intentionnellement exposés à un agent pathogène—sont jugés contraires à l’éthique, car il n’existe pas encore de remède contre la COVID-19.
- Les communautés sous-représentées exposées à la maladie grave, comme les personnes âgées, les membres de groupes raciaux/ethniques, les personnes enceintes et les personnes immunodéprimées, doivent participer de façon équitable à la recherche.
Des organes internationaux comme la Conférence internationale sur l’harmonisation (CIH) des bonnes pratiques cliniques conseillent les pays. De plus, l’OMS encourage tous les pays à se doter de groupes indépendants, les groupes consultatifs techniques nationaux pour la vaccination (GCTN), pour revoir les données vaccinales approuvées à la lumière de l’épidémiologie locale afin de déterminer qui devrait ou ne devrait pas recevoir le vaccin. Les GCTN renforcent les capacités nécessaires à l’établissement de normes mondiales d’innocuité des vaccins. Après les essais cliniques, nous continuons de contrôler l’innocuité des vaccins à l’aide des systèmes de surveillance de la santé publique.
Références
Dixon JR. The International Conference on Harmonization Good Clinical Practice guideline. Quality Assurance 1998;6(2):65-74. doi: 10.1080/105294199277860.
Doshi P. Pandemrix vaccine: why was the public not told of early warning signs? BMJ 2018;362:k3948 doi: 10.1136/bmj.k3948.
GAVI. Can vaccine clinical trials be sped up safely for COVID-19? https://www.gavi.org/vaccineswork/how-covid-19-leading-innovation-clinical-trials
Graham JE, Borda-Rodriguez A, Huzair F, Zinck E. Capacity for a global vaccine safety system: The perspective of national regulatory authorities. Vaccine 2012;30(33),4953-4959. doi:10.1016/j.vaccine.2012 .05.045.
Graham JE. Smart Regulation: Will the government’s strategy work? Canadian Medical Association Journal = Journal de l’Association médicale canadienne 2005;173(12),1469-1470. doi: 10.1503/cmaj.050424. Disponible: URL: https://www.cmaj.ca/content/173/12/1469.short
Graham JE, Nuttall R. Faster access to new drugs: fault lines between Health Canada’s regulatory intent and industry innovation practices. Ethics in Biology, Engineering & Medicine – An International Journal 2013;4(3),231-239. doi: 10.1615/EthicsBiologyEngMed.2014010771. http://hdl.handle.net/10222/75934
Harmon SHE, Faour DE, MacDonald NE, Graham JE, Steffen C, Henaff L, Shendale S. The Global NITAG Network Survey Correspondents. Immunization governance: Mandatory immunization in 28 Global NITAG Network countries. Vaccine. https://doi.org/10.1016/j.vaccine.2020.09.053
Herder M, Graham JE. Opinion: Herder and Graham: Canadians need and deserve transparency on COVID-19 vaccines. Ottawa Citizen, 15 septembre 2020. https://ottawacitizen.com/opinion/herder-and-graham-canadians-need-and-deserve-transparency-on-covid-19-vaccines
Morten CJ, Kapczynski A, Krumholz HM, Ross JS. To help develop the safest, most effective coronavirus tests, treatments, and vaccines, ensure public access to clinical research data. Health Affairs Blog, 26 mars 2020. https://www.healthaffairs.org/do/10.1377/hblog20200326.869114/full/
Pourquoi un essai clinique peut-il être arrêté temporairement?
Les essais cliniques sont interrompus s’il se produit une manifestation indésirable grave, comme une crise cardiaque, afin de déterminer si le vaccin en est la cause.
Ce qu’il faut savoir
- Un essai clinique est interrompu s’il se produit une manifestation indésirable grave
- Toute manifestation indésirable observée lors d’un essai clinique est évaluée par des experts indépendants pour déterminer si l’événement est lié au vaccin
- Si l’événement n’est pas lié au vaccin, l’essai clinique se poursuit
Les manifestations indésirables lors d’essais cliniques
Les grands essais cliniques sont menés sur des dizaines de milliers de participants. Les interruptions dues à des manifestations indésirables ne sont pas rares durant ces essais. Ces manifestations sont prises au sérieux, et les essais cliniques sont interrompus pour qu’une enquête ait lieu. Celle-ci permet aux experts de découvrir si le vaccin était la cause de la manifestation indésirable observée.
L’essai clinique reste en attente jusqu’à ce qu’il soit confirmé que le vaccin n’était pas la cause de la manifestation indésirable. Une enquête peut donner l’un de deux résultats :
- Si les experts ne peuvent pas dire avec certitude que le vaccin n’était pas la cause de la manifestation indésirable, l’essai clinique est définitivement stoppé, et les personnes qui y ont participé font l’objet de suivis médicaux.
- Si les experts peuvent confirmer que la manifestation indésirable n’était pas due au vaccin, c’est-à-dire qu’il s’agissait d’une coïncidence, l’essai clinique se poursuit.
Référence
AstraZeneca and J&J get go-ahead to resume Covid-19 vaccine trials. Consulté le 26 octobre 2020 dans https://www.ft.com/content/2d2d0e8c-3560-456f-bf3e-59a869e6aa00
INTRODUCTION DE VACCINS
Quels sont les rôles des personnels de santé de première ligne dans l’innocuité et l’efficacité des vaccins contre la COVID-19?
Les personnels de santé de première ligne contribuent en déclarant les manifestations indésirables et les cas d’échec vaccinal.
Ce qu’il faut savoir
- Les personnels de santé de première ligne déclarent aux autorités de santé publique les manifestations postvaccinales indésirables (MAPI) graves et les échecs vaccinaux possibles
- Les MAPI graves mais très rares sont moins courantes que les complications, les hospitalisations et les décès pouvant résulter de la COVID-19
- Les MAPI peuvent n’avoir aucun lien avec le vaccin et être entièrement fortuites
- Les personnels de santé de première ligne suivent les patients positifs pour la COVID-19
- Les fournisseurs de soins de santé aident à communiquer les mesures qui sont prises pour déterminer si une MAPI grave est causée par le vaccin
Personnels de santé et essais cliniques
Le fonctionnement d’un vaccin est contrôlé durant tout le processus vaccinal, à commencer par les différentes étapes de la recherche, qu’on appelle les essais cliniques. Ce sont des études qui disent aux scientifiques si le vaccin est sûr et s’il fonctionne. Cependant, les autorités sanitaires ont aussi besoin de savoir si le vaccin est performant dans le monde réel. Ces informations sont recueillies une fois que le vaccin est approuvé pour utilisation dans la population générale. Les personnels de santé de première ligne constituent un élément important de ce processus.
Les personnels de santé de première ligne jouent un rôle essentiel en recueillant auprès du grand public des informations sur l’innocuité et l’efficacité des vaccins. Ils sont un rouage important de la déclaration d’une manifestation postvaccinale indésirable (MAPI) et des situations où un vaccin semble avoir échoué.
Déclaration des MAPI
Une manifestation postvaccinale indésirable, ou MAPI, est une manifestation d’ordre médical inattendue qui suit la vaccination. S’il survient une MAPI, que ce soit durant les essais cliniques ou après l’approbation d’un vaccin pour utilisation, cela ne veut pas nécessairement dire que le vaccin en est la cause. Les circonstances entourant la MAPI doivent faire l’objet d’une enquête minutieuse pour savoir si le nouveau vaccin était vraiment le coupable. Les MAPI n’ont souvent aucun rapport avec la vaccination proprement dite.
Quand les personnels de santé de première ligne détectent une MAPI, ils recueillent les informations importantes à son sujet, puis les déclarent aux autorités de santé publique.
Pourquoi les informations sur les MAPI recueillies par les personnels de santé de première ligne sont importantes
Les informations sur les MAPI recueillies par les personnels de santé de première ligne aident les autorités de santé publique à comprendre si ces manifestations sont courantes ou rares et quelle est leur gravité. Les MAPI courantes sans gravité se résolvent habituellement d’elles-mêmes. Lorsqu’une MAPI grave ou rare est détectée, les autorités de santé publique et le programme d’immunisation travaillent étroitement avec les personnels de santé de première ligne à assurer la clarté des communications pendant la tenue d’une enquête pour déterminer si le vaccin est la cause de la MAPI.
Déclaration des échecs vaccinaux
Un échec vaccinal désigne une situation où un vaccin ne réussit pas aussi bien qu’il le devrait à protéger contre une maladie particulière. Les vaccins peuvent échouer pour deux raisons. La première est si le système immunitaire ne produit pas suffisamment d’anticorps après l’administration du vaccin. La deuxième est si le système immunitaire produit beaucoup d’anticorps au départ, mais n’arrive pas à soutenir ce niveau avec le temps. Dans les deux cas, le vaccin ne protège pas convenablement contre l’infection.
L’efficacité d’un vaccin peut dépendre de nombreux facteurs, comme l’âge, les troubles médicaux sous-jacents, le sexe, certains médicaments, la nutrition et le régime alimentaire, et la façon dont le vaccin a été entreposé et manipulé.
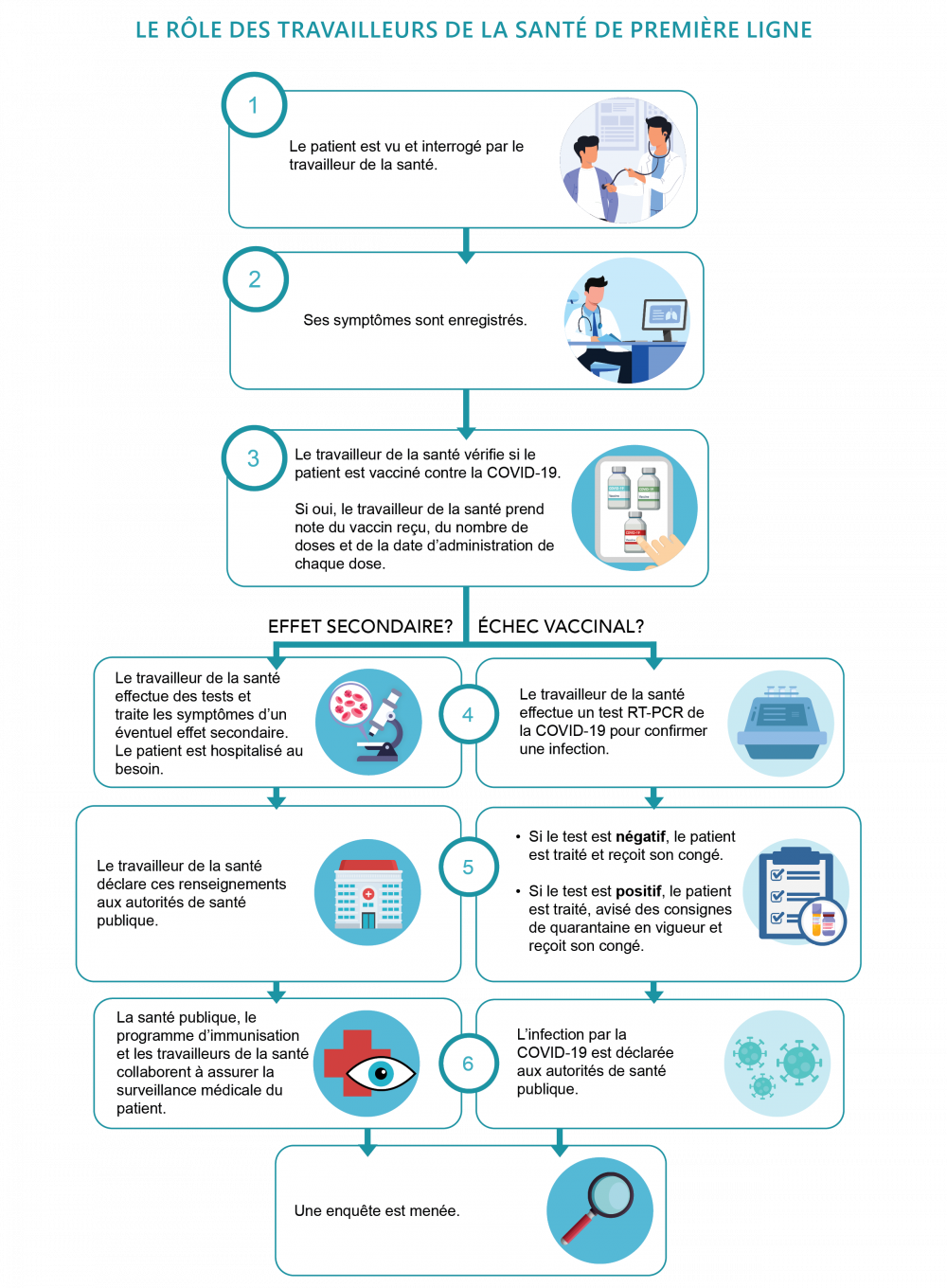
Les personnels de santé de première ligne jouent un grand rôle dans la détermination de l’efficacité d’un vaccin en déclarant les échecs vaccinaux possibles. Lorsqu’une patiente ou un patient semble avoir des symptômes de la COVID-19, les personnels de santé de première ligne prennent les mesures suivantes :
- Ils déterminent si la personne a reçu un vaccin contre la COVID-19. Si oui, ils prennent en note le vaccin reçu, le nombre de doses et la date de chaque dose.
- Ensuite, ils vérifient si le résultat du test de dépistage de la COVID-19 de cette personne est véritablement positif.
- En plus d’offrir des soins aux patients, les personnels de santé de première ligne déclarent les échecs vaccinaux suspectés—autrement dit, les cas où une personne a été vaccinée, mais que le résultat de son test de dépistage de la COVID-19 est quand même positif. Cette information est communiquée aux autorités de santé publique, qui font une enquête de suivi.
L’enquête détermine s’il y a vraiment eu échec vaccinal, et si oui, pourquoi. Les raisons d’un échec vaccinal peuvent être les suivantes :
- Le vaccin même n’a pas été capable d’offrir la protection voulue contre la COVID-19.
- Le vaccin n’a pas été correctement entreposé et manipulé, il y a eu des problèmes avec les ingrédients utilisés pour le produire, ou il y a eu une autre erreur dans le programme de vaccination.
- La personne vaccinée a un trouble médical sous-jacent qui a pu affecter la réponse de son système immunitaire au vaccin.
Une enquête plus poussée peut clarifier la cause et préciser si des échecs vaccinaux sont observés chez les autres personnes ayant reçu ce vaccin particulier.
Complément d’information pour les fournisseurs de soins de santé
Les manifestations postvaccinales indésirables (MAPI) sont évaluées selon leur gravité :
- Peu graves — la MAPI est bénigne, n’est pas potentiellement mortelle et se résout d’elle-même en quelques jours;
- Graves — la MAPI est potentiellement mortelle ou entraîne la mort, nécessite une hospitalisation ou provoque un handicap durable ou une anomalie congénitale;
et selon leur rareté :
- Courante — la MAPI survient chez plus d’1 personne sur 1 000 à 10 000;
- Rare — la MAPI survient chez moins d’1 personne sur 1 000, mais chez plus d’1 personne sur 10 000;
- Très rare — la MAPI survient chez moins d’1 personne sur 10 000.
Les MAPI courantes sans gravité
Les essais cliniques sont conçus pour détecter – et détectent habituellement – les MAPI courantes sans gravité avant que l’utilisation d’un vaccin ne soit approuvée. Les essais cliniques des vaccins contre la COVID-19 ont réussi à détecter les MAPI courantes (survenant chez 1 % à 10 % des participants aux essais). Par exemple, les données des essais cliniques de phase I, II et III et de pré-homologation de plusieurs vaccins contre la COVID-19 n’ont fait état d’aucune préoccupation grave liée à l’innocuité de ces vaccins selon les rapports publiés évalués par les pairs. Les MAPI courantes sans gravité de la vaccination contre la COVID-19 sont : le bras douloureux, la perte d’appétit, la rougeur au point d’injection et une légère fièvre. Comme les MAPI courantes sont habituellement bénignes et qu’elles se résolvent d’elles-mêmes sans intervention médicale, elles n’empêchent pas un vaccin d’être approuvé par les organismes de réglementation nationaux à moins d’être jugées excessives.
Les MAPI graves mais très rares
Les MAPI graves mais très rares ne surviennent que chez 0,01 % des personnes vaccinées. Elles sont quand même moins courantes que les événements graves dus à l’infection par la COVID-19, lesquels incluent les complications de santé, l’hospitalisation et la mort. Le nombre de participants de la plupart des essais cliniques n’est pas assez grand pour détecter ces MAPI graves mais très rares. Quand ce genre de MAPI est détecté, les autorités de santé publique et le programme d’immunisation travaillent étroitement avec les personnels de santé de première ligne à assurer la clarté des communications pendant la tenue d’une enquête pour déterminer si le vaccin est la cause de la MAPI.
Comme mentionné plus haut, les essais cliniques (avant et après l’approbation d’un vaccin) sont menés à trop petite échelle pour détecter les MAPI graves mais très rares et les échecs vaccinaux. Les personnels de santé de première ligne sont donc essentiels à la détection de ces événements dans la population générale.
L’information, l’autonomisation et le soutien des personnels de santé par le programme d’immunisation de leur pays sont indispensables à la détection et à la déclaration des cas suspectés de MAPI graves et d’échecs des vaccins contre la COVID-19. Ces personnels sont au centre du développement des connaissances sur l’efficacité et l’innocuité des vaccins contre la COVID-19 après leur homologation.
- Premièrement, tous les personnels de santé de première ligne doivent savoir comment déclarer une MAPI grave dans leur milieu. Un comité indépendant chargé de l’évaluation du lien de causalité détermine ensuite si, dans ce pays, la manifestation indésirable déclarée était due au vaccin, à une erreur de fabrication du vaccin, à une erreur du programme d’immunisation, à une réaction au stress de la vaccination, ou s’il s’agissait d’un événement fortuit sans rapport. Cela se fait selon un processus systématique d’examen des cas. L’Organisation mondiale de la santé (OMS) a élaboré un manuel de surveillance de l’innocuité des vaccins contre la COVID-19 (Covid-19 Vaccines: Safety Surveillance Manual) pour aider les pays à s’acquitter de cette tâche importante.
- Deuxièmement, tous les personnels de santé de première ligne recueillent des informations et déclarent les échecs vaccinaux possibles. À mesure que les cas d’échec vaccinal s’accumulent, des différences dans l’efficacité des vaccins peuvent être observées dans différentes tranches d’âge et dans d’autres sous-groupes et milieux. Ces informations sont importantes à l’échelle locale, nationale et mondiale. Selon les constats, il peut être nécessaire de modifier les recommandations d’utilisation du vaccin en question pour différentes tranches d’âge et/ou sous-groupes. Cela peut comprendre des doses supplémentaires, des intervalles différents, le besoin de doses de rappel, etc. À terme, ces informations permettent aux prestataires de soins de santé d’offrir des conseils plus précis sur l’intervalle entre la réception des doses vaccinales et la protection contre la maladie.
De plus, chaque pays partage ses constats pour permettre à tous de mieux comprendre l’efficacité des différents vaccins contre la COVID-19 à différents endroits. L’analyse des MAPI effectuée par le comité d’évaluation du lien de causalité est aussi déclarée au Centre de surveillance d’Uppsala, qui fait partie du Programme de l’OMS pour la pharmacovigilance internationale, y compris celle des vaccins.
Pour plus de détails, visitez : https://www.who-umc.org/ [en anglais].
Références
Petousis-Harris H. Assessing the safety of COVID-19 vaccines: a primer. Drug Safety 2020; 43:1205-10.
Vandenberg O, Martiny D, Rochas O, et al. Considerations for diagnostic COVID-19 tests. Nat Rev Microbiol 14 oct. 2020.
Gold MS, MacDonald NE, McMurtry MC, Balakrishnan MR, Heininger U, Menning L, et al. Immunization stress-related response – Redefining immunization anxiety-related reaction as an adverse event following immunization. Vaccine 2020;38(14):3015-20.
MacDonald NE, Guichard S, Arora N, Menning L, Wilhelm E. Lessons on causality assessment and communications from the 2019 South-East Asia Regional (SEAR) workshop on inter-country expert review of selected Adverse Events Following Immunization (AEFI) cases; 2019; Inter-country SEAR Workshop Participants, Communication Experts. Vaccine 2020; 38(32):4924-32.
Chandler RE. Optimizing safety surveillance for COVID-19 vaccines. Nature Reviews Immunology 2020;20(8):451-2.
Dorjee K, Kim H, Bonomo E, Dolma R. Prevalence and predictors of death and severe disease in patients hospitalized due to COVID-19: a comprehensive systematic review and meta-analysis of 77 studies and 38,000 patients. PLoS One 2020;15(12):e0243191.
Price-Haywood EG, Burton J, Fort D, Seoane L. Hospitalization and mortality among black patients and white patients with Covid-19. N Engl J Med 2020; 382(26):2534-43.
Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med 10 déc. 2020.
Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet 8 déc. 2020;397(10269):99-111. Doi: S0140-6736(20)32661-1.
Walsh EE, Frenck RW Jr, Falsey AR, Kitchin N, Absalon J, Gurtman A, et al. Safety and immunogenicity of two RNA-based Covid-19 vaccine candidates. N Engl J Med 14 oct. 2020.
Axell-House DB, Lavingia R, Rafferty M, Clark E, Amirian ES, Chiao EY. The estimation of diagnostic accuracy of tests for COVID-19: a scoping review. Journal of Infection 2020;81:681-97.
Liang L, Yang B, Jiang N, Fu W, He X, Zhou Y, et al. Three-month follow-up study of survivors of coronavirus disease 2019 after discharge. J Korean Med Sci 2020;35(47):e418.
World Health Organization. Causality assessment of an Adverse Event Following Immunization (AEFI) user manual for the revised WHP classification. Geneva: World Health Organization; 2018.
Que veut-on dire par l’évaluation risques-avantages du vaccin dans les populations hautement prioritaires?
L’évaluation risques-avantages sert à pondérer les résultats positifs et négatifs de la vaccination dans les populations à risque élevé.
Ce qu’il faut savoir
- Comme les vaccins servent à prévenir des maladies, les avantages de la vaccination doivent être beaucoup plus grands que tout risque de préjudice
- L’évaluation risques-avantages d’un vaccin diffère d’une population et d’une personne à l’autre, et elle peut varier dans le temps
- Un vaccin n’est approuvé pour utilisation par l’organisme de réglementation national que si son bilan avantages-risques est très positif
Que sont les avantages?
Une maladie évitable par la vaccination peut ne causer aucun symptôme. Mais elle peut aussi causer une maladie légère, modérée ou grave et entraîner des complications à long terme et même la mort. Ce que le vaccin prévient – les résultats négatifs de la maladie – sont désignés comme étant les avantages du vaccin.
Qu’est-ce que le risque?
Le risque est la possibilité d’un danger ou d’un préjudice. Lorsqu’on reçoit un vaccin, le risque désigne la possibilité qu’il ait un effet néfaste. Les risques possibles de l’administration des vaccins contre la COVID-19 sont détectés en assurant un contrôle continu de l’utilisation de ces vaccins et en déterminant si des effets néfastes ou des problèmes d’innocuité surviennent et sont dus aux vaccins. Aucun acte médical, aucun médicament n’est absolument sans risque. Par conséquent, les risques potentiels des vaccins contre la COVID-19 sont comparés aux risques graves connus pour la santé d’une personne qui contracte une infection par la COVID-19. Les risques sont aussi comparés aux avantages de recevoir le vaccin.
Avantages vs. risques
On appelle « évaluation risques-avantages » la pondération des avantages et des risques. Le niveau de risque que nous acceptons des vaccins est très faible. En effet, les vaccins sont administrés à des personnes en bonne santé, dont des jeunes enfants et des personnes vulnérables. Il faut absolument que les avantages d’un vaccin soient beaucoup plus importants que son risque éventuel d’effets néfastes.
Ce type d’évaluation risques-avantages est fondé sur des preuves scientifiques et est à la base de toutes les décisions réglementaires sur les vaccins. Un vaccin n’est approuvé pour utilisation par l’organisme de réglementation national que si l’évaluation risques-avantages montre que son utilisation comporte beaucoup plus d’avantages que de risques. C’est ce qu’on appelle un bilan avantages-risques positif.
L’évaluation risques-avantages d’un vaccin peut être différente pour des groupes particuliers, comme les enfants et les personnes immunodéprimées, comparativement aux adultes en bonne santé. Par exemple, certains vaccins (comme le vaccin inactivé contre l’influenza) ne fonctionnent pas pour les nourrissons de moins de 6 mois. Ils ne sont donc pas recommandés pour ce groupe d’âge. L’évaluation peut aussi être différente pour une personne qui vit dans une région aux prises avec une éclosion active de la maladie, car cette personne risque davantage d’être exposée à la maladie.
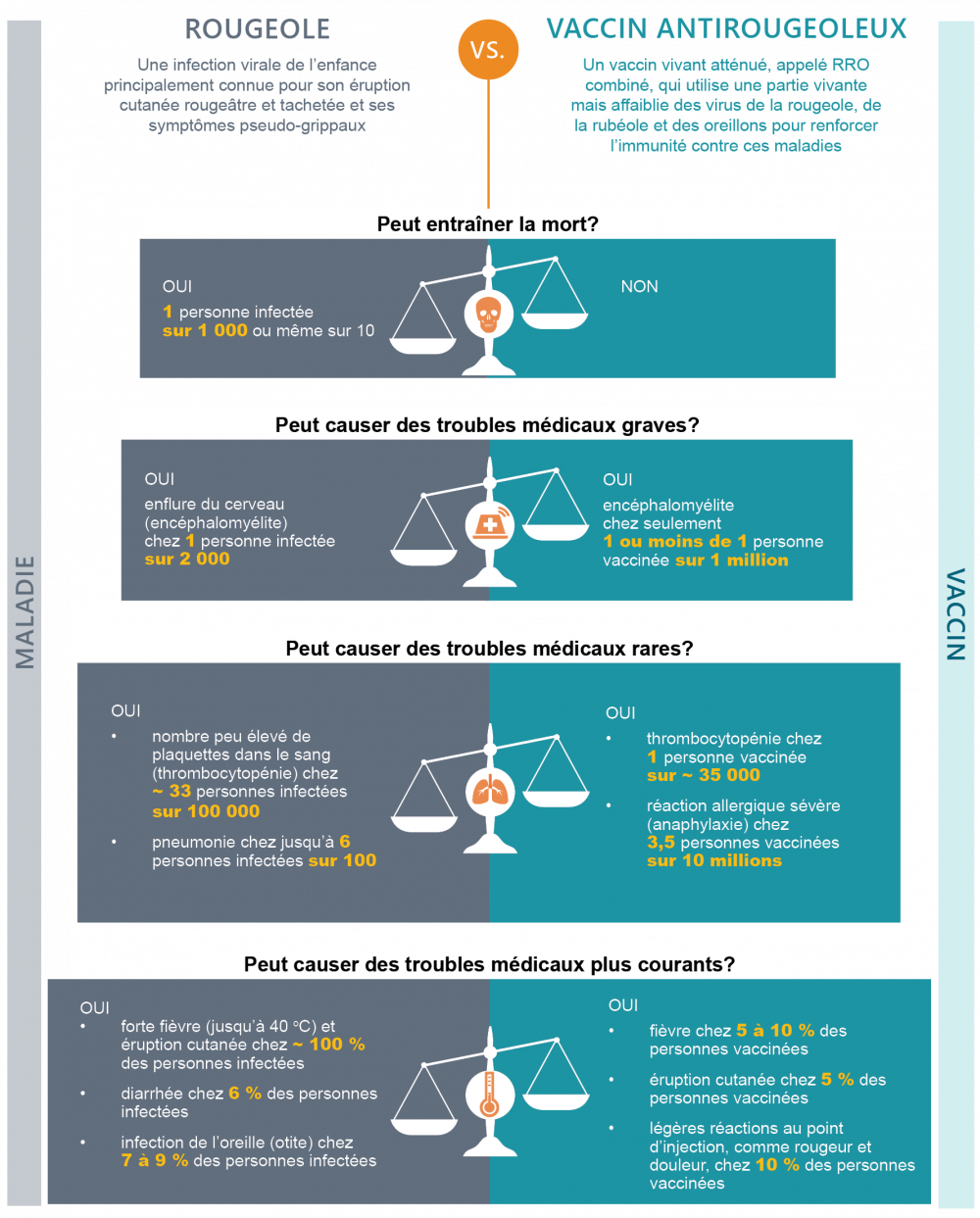
Voici l’exemple de l’évaluation risques-avantages du vaccin contre la rougeole.
Les populations hautement prioritaires
Les populations hautement prioritaires sont des groupes de gens qui présentent un risque plus élevé de contracter une maladie ou la forme grave d’une maladie. Ces gens recevraient un vaccin en priorité.
Dans le cas de la COVID-19, les populations hautement prioritaires sont les groupes qui présentent un risque plus élevé de contracter la forme grave de la COVID-19 ou d’en mourir, et ceux dont le risque d’exposition est plus élevé. Voici des exemples de populations hautement prioritaires pour la vaccination contre la COVID-19 :
- Les personnes âgées
- Les personnes immunodéprimées (incluant les personnes immunodéficientes, les patients atteints de cancers, les personnes enceintes, obèses ou diabétiques, celles qui font de l’hypertension artérielle et celles qui ont une cardiopathie ou une maladie chronique du poumon, du foie ou du rein)
- Les personnels de santé de première ligne
Complément d’information pour les fournisseurs de soins de santé sur les vaccins contre la COVID
Enfants et adolescents Il est recommandé aux enfants et aux adolescents (5 à 18 ans) de recevoir une série vaccinale complète de 2 doses suivie par une dose de rappel 6 mois plus tard. Les vaccins contre la COVID-19 (en série de 2 ou de 3 doses) sont autorisés pour les enfants de 6 mois à 5 ans n’ayant aucune contre-indication médicale. Il est recommandé d’administrer à ce groupe d’âge la série complète de 2 doses du vaccin Spikevax de Moderna (avec un intervalle d’au moins 8 semaines entre chaque dose). Le vaccin contre la COVID-19 ne devrait pas être administré le même jour qu’un autre vaccin (à virus vivant ou mort).
Les enfants de 6 mois à 11 ans présentant une ou plusieurs des caractéristiques suivantes peuvent être plus à risque de contracter la forme grave de la COVID-19; la vaccination est vivement recommandée dans leur cas :
- Médicalement fragiles
- Obèses
- Ayant des troubles médicaux complexes, avec plus d’une comorbidité
- Ayant des troubles neurologiques
- Présentant une dysrégulation immunitaire associée au syndrome de Down (trisomie 21)
- Présentant une affection liée à l’immunodépression
Pour les jeunes enfants (6 mois à 5 ans) modérément à sévèrement immunodéprimés, la recommandation est de leur administrer la série primaire de 3 doses du vaccin Spikevax de Moderna, en prévoyant un intervalle de 4 à 8 semaines entre chaque dose.
Pour les enfants et les adolescents (5 à 18 ans) modérément à sévèrement immunodéprimés, la recommandation est de leur administrer une série primaire de 3 doses d’un vaccin contre la COVID-19 (avec un intervalle de 4 à 8 semaines entre chaque dose), suivie d’une dose de rappel. L’utilisation des vaccins à ARNm contre la COVID-19 pour les doses de rappel n’est pas autorisée à l’heure actuelle pour les enfants et les adolescents (moins de 18 ans).
Pour les adolescents (12 à 17 ans) qui peuvent être plus à risque de contracter la forme grave de la COVID-19, dont ceux qui présentent une ou plusieurs des affections suivantes, la recommandation est de leur administrer une série primaire complète de 3 doses d’un vaccin contre la COVID-19, suivie d’une dose de rappel dans un délai de 6 mois de la série complète :
- Cancer
- Maladies du rein chroniques
- Maladies pulmonaires chroniques (comme l’asthme)
- Fibrose kystique
- Troubles neurodéveloppementaux et autres troubles neurologiques chroniques, y compris l’épilepsie et les maladies cérébrovasculaires
- Diabète (types 1 et 2)
- Syndrome de Down (trisomie 21)
- Cardiopathie congénitale (et autres maladies cardiaques chroniques), y compris l’hypertension pulmonaire
- Maladie du foie chronique
- Obésité (IMC de 30 ou plus)
- Grossesse
- Drépanocytose ou thalassémie
- Troubles de consommation de substances
- État immunodéprimé, y compris déficience immunitaire primaire, greffe d’un organe plein ou de cellules souches hématopoïétiques, infection à VIH ou traitement immunosuppresseur
- Personne médicalement fragile et ayant des besoins complexes sur le plan médical
Personnes antérieurement infectées par la COVID-19 : Bien qu’une infection antérieure par la COVID-19 puisse offrir une certaine protection, la vaccination après l’infection confère une protection plus forte, plus durable et plus large. Il est recommandé d’offrir les vaccins à ARNm contre la COVID-19 à ces personnes (5 ans et plus). Ici encore, il est autorisé de vacciner les enfants plus jeunes (6 mois à 5 ans).
Adultes Il est recommandé à tous les adultes de recevoir une série primaire, de préférence d’un vaccin à ARNm contre la COVID-19, suivie de doses de rappel (soit 3 ou 4 doses en tout). Après la dose initiale de vaccin, les doses subséquentes devraient être administrées à 8 semaines d’intervalle.
Certains adultes sont plus à risque de contracter la forme grave de l’infection par la COVID-19 et d’être hospitalisés ou même d’en mourir. Ces adultes sont exhortés à se faire vacciner avec une série primaire et à recevoir une ou deux doses de rappel. Ce sont les personnes suivantes :
- Personnes âgées : 70 ans et plus (surtout celles qui ont plus de 80 ans)
- Personnes enceintes ou qui allaitent
- Personnes atteintes d’une maladie auto-immune : L’auto-immunité peut nuire à la capacité du système immunitaire de combattre les virus. Il est recommandé d’administrer un vaccin à ARNm contre la COVID-19 aux personnes atteintes d’une maladie auto-immune.
- Personnes immunodéprimées : Un système immunitaire affaibli ne peut pas combattre les maladies infectieuses avec autant de force qu’il ne le faut. Aux personnes qui sont modérément à sévèrement immunodéprimées, il est recommandé d’administrer 3 doses d’un vaccin à ARNm contre la COVID-19.
La vaccination est également recommandée aux adultes antérieurement en bonne santé dans des circonstances particulières :
- Personnes antérieurement infectées par la COVID-19 : Bien qu’une infection antérieure par la COVID-19 puisse offrir une certaine protection, la vaccination après l’infection confère une protection plus forte et plus durable; il est recommandé d’offrir les vaccins à ARNm contre la COVID-19 à ces personnes (5 ans et plus).
- Voyageurs : Les voyageurs courent un risque d’exposition accru. Ils devraient recevoir la série complète d’un vaccin contre la COVID-19 au moins 14 jours avant le départ. Il faut prévoir deux semaines ou plus pour respecter les formalités d’admission dans d’autres pays.
- Nouveaux arrivants au Canada : Comme les voyageurs, les nouveaux arrivants peuvent courir un risque d’exposition accru; ils peuvent aussi ne pas avoir reçu un type de vaccin contre la COVID-19 approuvé au Canada. L’Agence de la santé publique du Canada (ASPC) recommande aux personnes qui prévoient vivre, travailler et/ou étudier au Canada de recevoir la série complète d’un vaccin contre la COVID-19 autorisé par Santé Canada avec des doses de rappel (soit 3 ou 4 doses en tout).
Pour plus de détails, veuillez visiter : https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-4-agents-immunisation-active/page-26-vaccin-contre-covid-19.html#a6
Références
Arlegui H, Bollaerts K, Salvo F, et al. Benefit–risk assessment of vaccines. Part I: a systematic review to identify and describe studies about quantitative benefit–risk models applied to vaccines. Drug Saf 2020. https://doi.org/10.1007/s40264-020-00984-7
U.S. Food and Drug Administration. Benefit-risk assessment in drug regulatory decision-making. Draft PDUFA VI implementation plan (FY 2018-2022); 30 mars 2018. Consulté le 30 sept. 2020 sur https://www.fda.gov/media/112570/download
Booth A, Reed AB, Ponzo S, Yassaee A, Aral M, Plans D, et al. Population risk factors for severe disease and mortality in COVID-19: a global systematic review and meta-analysis. PLoS One 4 mars 2021; 16(3):e0247461. doi: 10.1371/journal.pone.0247461.
Curtin F, Schulz P. Assessing the benefit: risk ratio of a drug – randomized and naturalistic evidence. Dialogues Clin Neurosci 2011;13(2):183-90. PMID: 21842615; PMCID: PMC3181998.
Comité consultatif national de l’immunisation (CCNI). Recommandations sur l’utilisation du vaccin Spikevax de Moderna contre la COVID-19 chez les enfants de 6 mois à 5 ans. Agence de la santé publique du Canada; 14 juillet 2022. https://www.canada.ca/fr/sante-publique/services/immunisation/comite-consultatif-national-immunisation-ccni/recommandations-utilisation-vaccin-spikevax-moderna-contre-covid-19-enfants-6-mois-5-ans.html
Rémy V, Zöllner Y, Heckmann U. Vaccination: the cornerstone of an efficient healthcare system. J Mark Access Health Policy 2015;3:10.3402/jmahp.v3.27041. doi:10.3402/jmahp.v3.27041
OMS Europe. Risk scales: benefits of vaccines far outweigh the risks. Consulté le 9 oct. 2020 sur https://www.euro.who.int/en/health-topics/disease-prevention/vaccines-and-immunization/publications/2017/risk-scales-benefits-of-vaccines-far-outweigh-the-risks-2017
Quels sont les effets secondaires courants des vaccins contre la COVID-19?
Les effets secondaires courants sont la douleur et/ou la rougeur et l’enflure au point d’injection, une fièvre légère, la fatigue, les maux de tête et de légères douleurs musculaires et/ou articulaires.
Ce qu’il faut savoir
- Comme pour la plupart des vaccins, les effets secondaires courants des vaccins contre la COVID-19 sont habituellement légers et se résolvent d’eux-mêmes
- Les effets secondaires sont causés par le vaccin, tandis que certaines manifestations postvaccinales indésirables peuvent être de simples coïncidences
Qu’est-ce qu’une manifestation postvaccinale indésirable?
Une manifestation indésirable après un vaccin (également appelée manifestation postvaccinale indésirable ou MAPI) est une manifestation d’ordre médical non désirée éprouvée après avoir reçu un vaccin. Durant les essais cliniques, même le placebo (solution saline) peut causer des MAPI. Une manifestation indésirable n’est pas nécessairement due au vaccin. Dans bien des cas, il s’agit d’une coïncidence. Certaines MAPI sont causées par le vaccin même; on les appelle les effets secondaires. D’autres peuvent être liées à la procédure d’immunisation. Les MAPI courantes ou fréquentes sont habituellement bénignes. Les effets secondaires légers après un vaccin ne sont pas rares et peuvent être imputés à l’activation du système immunitaire.
Des MAPI bénignes surviennent couramment, d’habitude dans les heures qui suivent l’injection. Elles se résolvent d’elles-mêmes en quelques jours. Les effets secondaires légers sont :
- La douleur et/ou la rougeur et l’enflure au point d’injection. Elles se manifestent par exemple chez 15 % des adultes et 5 % des enfants qui reçoivent le vaccin contre l’hépatite B.
- Une fièvre légère (plus de 38 °C, mais moins de 39 °C). Elle se manifeste par exemple chez 10 % des personnes qui reçoivent le vaccin contre le tétanos.
Il peut arriver qu’une MAPI courante (comme une enflure) soit jugée grave. C’est le cas par exemple d’un bras rouge et très enflé chez un jeune enfant ayant reçu un vaccin hexavalent.
Effets secondaires possibles des vaccins
N’importe quel vaccin peut avoir des effets secondaires. La plupart des effets secondaires courants des vaccins sont légers et disparaissent d’eux-mêmes en quelques jours. C’est le cas pour le BCG (bacille de Calmette et Guérin) et pour les vaccins contre l’hépatite B et l’haemophilus influenzae de type b, entre autres.

Effets secondaires des vaccins contre la COVID-19
Les MAPI bénignes courantes des vaccins à ARNm contre la COVID-19 sont :
- La fatigue (chez 20 à 30 % des adultes)
- Les maux de tête (chez 20 % des adultes)
- De légères douleurs musculaires et/ou articulaires (chez 20 % des adultes)
Réactions allergiques aux vaccins
Les réactions allergiques ne sont pas la même chose que les effets secondaires. Bien que des réactions allergiques, comme l’anaphylaxie, soient possibles, elles sont très rares. Elles surviennent quelques minutes après l’administration d’un vaccin. Elles sont habituellement causées par une allergie à un ingrédient particulier du vaccin, comme la néomycine. Étant donné que l’anaphylaxie est potentiellement mortelle, les prestataires de soins de santé sont toujours formés et préparés à la traiter lorsqu’ils injectent un vaccin.
Manifestations postvaccinales indésirables graves
Les MAPI courantes ou fréquentes sont habituellement bénignes. Des MAPI graves peuvent survenir, mais très rarement. Une MAPI n’est jugée grave que si elle :
- Entraîne la mort
- Est potentiellement mortelle
- Nécessite (ou prolonge) l’hospitalisation d’une personne
- Est persistante, c’est-à-dire qu’elle ne se résout pas d’elle-même
- Cause une invalidité et/ou un handicap important
- Entraîne une anomalie congénitale et/ou une déficience de naissance
- Nécessite une intervention médicale pour prévenir un préjudice important
Pour en savoir plus sur les MAPI, cliquez ici.
Complément d’information pour les fournisseurs de soins de santé
Les essais cliniques de phase III des vaccins contre la COVID-19 n’ont révélé que très peu de manifestations indésirables. Celles qui sont survenues n’étaient pas graves. Les vaccins ont aussi été jugés très efficaces pour prévenir les hospitalisations ou les décès dus à l’infection par la COVID-19.
Les manifestations postvaccinales indésirables sont catégorisées comme suit :
- Réaction liée à un produit vaccinal
- Réaction liée à la qualité du vaccin
- Réaction liée à une erreur d’immunisation
- Réaction liée au stress de l’immunisation
- Coïncidence
La rougeur, la douleur et l’enflure au point d’injection sont normales pour n’importe quel vaccin injectable. D’autres effets secondaires ont été confirmés pour les vaccins approuvés contre la COVID-19 utilisés au Canada :
-
Le vaccin Comirnaty de Pfizer-BioNTech contre la COVID-19 peut causer des maux de tête, des frissons, des douleurs articulaires, de la fatigue, des douleurs musculaires, une fièvre légère et des frissons. Ces effets secondaires sont plus courants chez les jeunes vaccinés. La plupart des effets secondaires après la deuxième dose étaient légers à modérés.
Les effets secondaires rares mais graves de ce vaccin sont la myocardite et la péricardite (inflammation du muscle cardiaque et/ou de l’enveloppe du cœur) et la paralysie faciale (paralysie de Bell).
-
De légers effets secondaires courants semblables ont été déclarés pour le vaccin Spikevax de Moderna contre la COVID-19. Les autres effets secondaires courants de ce vaccin sont les nausées, les vomissements, l’irritabilité, la somnolence et la perte d’appétit. Les manifestations indésirables systémiques seraient plus courantes après la deuxième dose et chez les personnes ayant reçu la dose la plus forte. L’enflure généralisée du membre vacciné a été déclarée spontanément.
Les effets secondaires rares mais graves de ce vaccin sont la myocardite/péricardite et la paralysie de Bell.
-
Le vaccin Vaxzevria d’AstraZeneca contre la COVID-19 peut lui aussi causer de la fatigue, des douleurs articulaires, des maux de tête, une fièvre légère, des frissons et des douleurs musculaires. L’acouphène (tintement persistant dans les oreilles) est un effet secondaire peu courant. La paresthésie (picotements inhabituels ou fourmillements dans la peau) et l’hypoesthésie (diminution des sensations ou de la sensibilité) ont aussi été spontanément déclarées.
Les effets secondaires rares mais graves de ce vaccin sont les caillots sanguins (avec plaquettes peu élevées), la fuite de liquide des petits vaisseaux sanguins (syndrome de fuite capillaire) et le syndrome de Guillain-Barré (qui amène le système immunitaire du corps à endommager les cellules nerveuses).
-
Le vaccin de Janssen (Johnson & Johnson) contre la COVID-19 peut causer les mêmes effets secondaires légers que le vaccin d’AstraZeneca.
Les effets secondaires rares mais graves de ce vaccin sont les caillots sanguins avec plaquettes peu élevées, le syndrome de fuite capillaire et le syndrome de Guillain-Barré.
-
De légers effets secondaires courants semblables ont été déclarés pour le vaccin Nuvaxovid de Novavax contre la COVID-19. Les autres effets secondaires courants de ce vaccin sont les nausées et les vomissements.
Les effets secondaires rares mais graves de ce vaccin sont l’anaphylaxie (une réaction allergique grave) causant de l’urticaire (bosses sur la peau qui causent souvent beaucoup de démangeaisons); une enflure des lèvres, du visage, de la langue ou des voies respiratoires; des difficultés respiratoires; une augmentation du rythme cardiaque; une perte de conscience; une chute soudaine de la pression artérielle; et/ou des douleurs abdominales, des vomissements et de la diarrhée. Quelques cas de paresthésie (picotements inhabituels ou fourmillements dans la peau), d’hypoesthésie (diminution des sensations ou de la sensibilité) et de myocardite/péricardite ont été déclarés.
-
Le vaccin Covifenz de Medicago contre la COVID-19 peut causer des frissons, de la fatigue, des douleurs articulaires, des maux de tête, une fièvre légère, des douleurs musculaires, de la congestion nasale, un mal de gorge, de la toux, des nausées et de la diarrhée.
L’anaphylaxie est un effet secondaire rare mais grave de ce vaccin.
Pour plus de détails, veuillez consulter : https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/covid19-industrie/medicaments-vaccins-traitements/vaccins.html
Références
Anderson EJ, Rouphael NG, Widge AT, Jackson LA, Roberts PC, et al. Safety and immunogenicity of SARS-CoV-2 mRNA-1273 vaccine in older adults. N Engl J Med 29 sept. 2020. doi: 10.1056/NEJMoa2028436.
Agence européenne des médicaments. COVID-19 vaccines safety update; 14 juillet 2022. https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-vaccines-safety-update-14-july-2022_en.pdf
Grech V, Calleja N. Theoretical novel COVID-19 vaccination risk of rare and severe adverse events versus COVID-19 mortality. Early Hum Dev 1er oct. 2020:105212. doi: 10.1016/j.earlhumdev.2020.105212
Pfizer says Covid-19 vaccine showed moderate side effects. https://www.clinicaltrialsarena.com/news/pfizer-covid-vaccine-tolerability-data/
WHO vaccine safety basics e-learning course; 18 oct. 2020. https://openwho.org/courses/vaccine-safety-basics
Que se passe-t-il lorsqu’une personne éprouve une manifestation indésirable?
Les manifestations indésirables bénignes sont suivies, et les manifestations indésirables graves sont traitées immédiatement et déclarées au comité d’évaluation du lien de causalité.
Ce qu’il faut savoir
- Toutes les MAPI graves font l’objet d’une enquête pour déterminer si le vaccin en est la cause
- Les MAPI bénignes se résolvent d’elles-mêmes sans intervention médicale, mais les MAPI graves sont traitées immédiatement
On appelle « manifestations postvaccinales indésirables » (MAPI) les manifestations indésirables éprouvées après la vaccination. Elles sont généralement bénignes et se résolvent d’elles-mêmes. Les MAPI courantes bénignes (comme une fièvre légère et de la rougeur ou une enflure au point d’injection) ne sont généralement pas déclarées aux autorités de santé publique. Par contre, quelques MAPI très rares peuvent être graves (voir ci-dessous). Lorsqu’une MAPI est grave, elle est déclarée aux autorités de santé publique et fait l’objet d’une enquête pour déterminer si elle est due ou non au vaccin ou au processus d’immunisation.
MAPI très courantes, courantes, peu courantes, rares et très rares
Les MAPI sont catégorisées selon leur fréquence dans une population vaccinée :
Les MAPI très courantes surviennent chez moins de 20 % des personnes vaccinées. Leurs symptômes se manifestent habituellement dans les heures qui suivent la vaccination et se résolvent d’eux-mêmes en peu de temps sans effets à long terme. Ce sont souvent des réactions attendues qui montrent que le système immunitaire a été activé. Les MAPI courantes bénignes peuvent inclure :
- Une fièvre légère
- Des douleurs musculaires et des courbatures
- De la sensibilité, de la rougeur et/ou une enflure au point d’injection
Il importe de signaler que certaines MAPI bénignes sont aussi observées durant les essais cliniques où les participants reçoivent une injection de solution saline comme placebo. C’est le processus d’immunisation qui en est la cause, spécifiquement l’injection de l’aiguille à travers la peau et les muscles.
Déclaration des MAPI
Pour tout nouveau vaccin (comme les vaccins contre la COVID-19), au début, toutes les MAPI, même bénignes, sont déclarées par les fournisseurs de soins de santé. Des plateformes nationales ouvertes au public, comme le réseau national canadien de sécurité vaccinale (CANVAS), sont également utilisées pour recueillir ce type d’informations. Lorsque les MAPI bénignes causées par un nouveau vaccin sont bien connues, elles ne sont habituellement plus déclarées.
Les MAPI graves font toujours l’objet d’une enquête minutieuse, peu importe si le vaccin est nouveau ou s’il a une longue fiche de résultats. On veut ainsi découvrir, pour la patiente ou le patient en question, si le vaccin ou la procédure d’immunisation a causé la MAPI grave ou s’il s’agissait d’un événement fortuit sans rapport avec l’immunisation. L’analyse de la causalité nécessite des informations complètes sur l’événement médical, le vaccin, les circonstances de l’immunisation et d’autres informations, comme si la MAPI a été observée durant un essai clinique, si elle a été déclarée auparavant pour ce vaccin, etc.
MAPI très rares mais graves
Les MAPI graves sont traitées d’urgence par les personnels de santé.
Une MAPI est jugée grave si elle est potentiellement mortelle, si elle entraîne l’hospitalisation, si elle ne se résout pas d’elle-même, si elle nuit à la capacité de bouger ou de penser clairement, si elle cause des anomalies congénitales ou si elle nécessite des soins médicaux pour prévenir des préjudices graves.
Les MAPI graves ne surviennent que chez moins d’1 personne sur 10 000. Parce qu’elles sont si rares, elles ne sont habituellement pas détectées lors des essais cliniques, qui portent généralement sur un assez petit nombre de personnes. Les MAPI graves font immédiatement l’objet d’une enquête pour déterminer si elles ont été causées par le vaccin même, par le processus d’immunisation ou s’il s’agit d’une coïncidence. La plupart sont des coïncidences. Si la MAPI grave est bel et bien causée par le vaccin, les recommandations d’utilisation du vaccin peuvent être modifiées.
Complément d’information pour les fournisseurs de soins de santé
Le processus de pré-approbation d’un vaccin est rigoureux pour garantir que les MAPI bénignes courantes ont été détectées et que le vaccin prévient efficacement la maladie grave. Une haute qualité de fabrication du vaccin est aussi exigée. Il est très rare qu’une MAPI grave soit due à un problème avec le vaccin.
Les personnels de santé collaborent étroitement avec les autorités de santé publique et leurs établissements pour assurer l’exactitude des informations fournies et validées et pour ne pas perpétuer de mésinformation. Les personnels de santé jouent un rôle très important dans la surveillance des MAPI, car ce sont eux et elles qui :
- Reconnaissent et déclarent les MAPI graves aux autorités de santé publique
- Offrent immédiatement des soins aux personnes qui éprouvent des MAPI graves
- Aident à recueillir pour le comité d’évaluation du lien de causalité des informations qui détermineront si la MAPI grave est due au vaccin, à la procédure d’immunisation ou à un événement fortuit (une coïncidence)
- Demeurent objectifs en essayant de déterminer la cause de la MAPI
- Communiquent de façon factuelle, efficace, opportune et respectueuse
Les autorités de santé publique locales ont, elles aussi, la responsabilité de communiquer ouvertement les informations sur les MAPI graves et sur les mesures qui sont prises pour faire enquête et pour déterminer si elles constituent vraiment un effet secondaire du vaccin.
Références
Gold MS, MacDonald NE, McMurtry CM, Balakrishnan MR, Heininger U, Menning L, et al. Immunization stress-related response – Redefining immunization anxiety-related reaction as an adverse event following immunization. Vaccine 2020;38(14):3015-20.
Organisation mondiale de la santé. Bureau régional de l’Europe. Crisis communication template; 2017. Consulté le 24 sept. 2020. https://www.euro.who.int/en/health-topics/disease-prevention/vaccines-and-immunization/publications/2017/crisis-communications-plan-template-2017
Organisation mondiale de la santé. Vaccine Safety Basics e-learning course. Module 4: Surveillance. Causality Assessment of AEFIs. Consulté le 24 sept. 2020. https://openwho.org/courses/vaccine-safety-basics
Organisation mondiale de la santé. Vaccine Safety Basics e-learning course. Module 3. Adverse events following immunization. Consulté le 24 sept. 2020. https://openwho.org/courses/vaccine-safety-basics
EFFETS À LONG TERME
Les vaccins contre la COVID-19 peuvent-ils affecter la fertilité future et les règles?
Les vaccins contre la COVID-19 ne causent ni l’infertilité, ni des changements des règles.
Ce qu’il faut savoir
- L’idée que l’immunisation cause l’infertilité est une rumeur courante quand de nouveaux vaccins sont introduits.
- Après l’administration de millions de doses de vaccins contre la COVID-19 dans le monde, aucune preuve n’indique que ces vaccins affectent la fertilité, le cycle menstruel ou la puberté.
- Les essais cliniques des vaccins à ARNm contre la COVID-19 n’ont fait état d’aucun problème d’infertilité chez les hommes ni les femmes.
Les préoccupations concernant l’immunisation et la fertilité n’ont rien de nouveau!
La crainte que l’immunisation puisse affecter la fertilité n’a rien de nouveau. Ce mythe bien ancré est alimenté par la mésinformation et cause de sérieux maux de tête aux autorités de santé publique. Au début des années 2000 par exemple, cette croyance a causé un boycott du vaccin contre la polio dans le Nord du Nigeria. Le public craignait que le vaccin ne contienne des ingrédients causant l’infertilité, mais c’était faux. Des craintes semblables ont été exprimées au Canada quand le programme de vaccination en milieu scolaire contre le virus du papillome humain (VPH) a démarré.
Les preuves sont claires : aucun vaccin (y compris ceux contre la COVID-19) administré pour prévenir des maladies infectieuses ne cause l’infertilité. Néanmoins, cette peur subsiste! En fait, les recherches dans Google sur les vaccins contre la COVID-19 et la fertilité/l’infertilité se classaient parmi les cinq sujets de recherche les plus populaires en février 2021.
Les vaccins contre la COVID-19 et la fertilité
Les essais cliniques des vaccins à ARNm contre la COVID-19 n’ont fait état d’aucun problème d’infertilité. Les études ont montré qu’il n’y a aucun changement du nombre de spermatozoïdes après la vaccination contre la COVID-19. D’autres grandes études ne font état d’aucun changement dans la fertilité, la menstruation ou la puberté, même après l’administration de millions de doses dans le monde. Comme par le passé avec d’autres vaccins, les craintes que la vaccination ne nuise à la fertilité étaient des rumeurs sans fondement.
Riposte à la mésinformation sur la vaccination contre la COVID-19
Pour riposter à la mésinformation très répandue sur la vaccination contre la COVID-19 et les craintes pour la fertilité, des organismes spécialistes de la fertilité comme l’American College of Obstetricians and Gynecologists, l’American Society for Reproductive Medicine, la Society for Maternal-Fetal Medicine et la Société des obstétriciens et gynécologues du Canada ont publié des déclarations catégoriques pour confirmer qu’il n’y a absolument aucune preuve que les vaccins contre la COVID-19 causent l’infertilité. La British Fertility Society a aussi élaboré un guide dont voici quelques faits saillants :
- Aucun élément de preuve n’indique que les vaccins approuvés contre la COVID-19 puissent nuire à la fertilité des femmes ou des hommes.
- Le vaccin contre la COVID-19 n’affecte pas la capacité de faire des dons d’ovules ou de sperme, ni de recevoir un traitement de fécondation in vitro.
- Les adultes et les adolescent·es devraient se faire vacciner contre la COVID-19, car c’est une maladie grave contre laquelle il n’existe pas de remède.
La vaccination contre la COVID-19 et la puberté
La North American Society for Pediatric and Adolescent Gynecology souligne qu’il n’y a aucune preuve que la vaccination contre la COVID-19 affecte la puberté ou la croissance. Il est courant d’avoir un cycle menstruel imprévisible dans années qui suivent l’apparition des premières règles à l’adolescence. La Société explique aussi que le fait d’avoir un cycle menstruel irrégulier après avoir reçu un vaccin contre la COVID-19 (ou après s’être rétablie d’une infection par la COVID-19) n’a rien d’étonnant, car les infections, les réactions immunitaires et la fièvre sont toutes des causes connues des variations à court terme du cycle menstruel.
Complément d’information pour les fournisseurs de soins de santé
Globalement, il est incorrect de prétendre que les vaccins contre la COVID-19 ont un effet nuisible sur la fertilité et la croissance. Les experts informent les adultes et les adolescent·es, comme l’a fait la British Fertility Society, qu’il n’existe aucune preuve et aucune raison théorique de soupçonner qu’un quelconque vaccin puisse nuire à la fertilité des femmes ou des hommes.
Références
American College of Obstetricians and Gynecologists, American Society for Reproductive Medicine, Society for Maternal-Fetal Medicine. News: Medical experts continue to assert that COVID vaccines do not impact fertility. American College of Obstetricians and Gynecologists; 4 févr 2021. https://www.acog.org/news/news-releases/2021/02/medical-experts-assert-covid-vaccines-do-not-impact-fertility
Association of Reproductive and Clinical Scientists, British Fertility Society. COVID-19 vaccines and fertility; 8 févr 2021. www.britishfertilitysociety.org.uk/wp-content/uploads/2021/02/Covid19-Vaccines-FAQ-1_3.pdf
Bowman CJ, Bouressam M, Campion SN, Cappon GD, Catlin NR, Cutler MW, et al. Lack of effects on female fertility and prenatal and postnatal offspring development in rats with BNT162b2, a mRNA-based COVID-19 vaccine. Reprod Toxicol 2021;103:28-35.
Diaz P, Reddy P, Ramasahayam R, Kuchakulla M, Ramasamy R. COVID-19 vaccine hesitancy linked to increased internet search queries for side effects on fertility potential in the initial rollout phase following Emergency Use Authorization. Andrologia juin 2021:e14156.
Gonzalez, DC, Nassau DE, Khodamoradi K, Ibrahim E, Blachman-Braun R, Ory J, Ramasamy R. Sperm parameters before and after COVID-19 mRNA vaccination. JAMA 2021;326(3):273-4.
Iacobucci G. Covid-19: No evidence that vaccines can affect fertility, says new guidance. BMJ 2021;372:n509.
Société des obstétriciens et gynécologues du Canada. Déclaration de la SOGC sur la vaccination contre la COVID-19 et la fertilité. La Société; 18 mars 2021. https://www.sogc.org/common/Uploaded%20files/Latest%20News/FR_SOGCStatement_COVID-19Vaccination-Fertility.pdf
Talib H, Berlan ED, Tyson N. NASPAG. NASPAG Advocacy Committee. North American Society for Pediatric and Adolescent Gynecology; mai 2021. https://www.naspag.org/naspag-position-statement-on-covid-19-vaccines-and-gynecologic-concerns-in-adolescent-and-young-adults
Watson RE, Nelson TB, Hsu AL. American Society for Reproductive Medicine. Fertility considerations: The COVID-19 disease may have a more negative impact than the COVID-19 vaccine, especially among men. Fertility and Sterility. American Society for Reproductive Medicine; 19 mars 2021. https://www.fertstertdialog.com/posts/fertility-considerations-the-covid-19-disease-may-have-a-more-negative-impact-than-the-covid-19-vaccine-especially-among-men?room_id=871-covid-19
Yahya M. Polio vaccines – "No thank you!". Barriers to polio eradication in Northern Nigeria. African Affairs 2007;106(423):185-204.
Si un vaccin présentait des problèmes d’innocuité à long terme, comment le saurions-nous?
Des systèmes de surveillance de la santé publique sont utilisés pour surveiller les manifestations postvaccinales indésirables sur une longue période.
Ce qu’il faut savoir
- Les manifestations postvaccinales indésirables (MAPI) sont surveillées aussi longtemps qu’un vaccin est utilisé.
- Deux types de surveillance (active et passive) sont employés pour surveiller les MAPI d’intérêt particulier.
Les organismes de réglementation nationaux approuvent les vaccins et en surveillent l’innocuité
Les organismes de réglementation nationaux, comme Santé Canada et la Food and Drug Administration (FDA) des États-Unis, ont la responsabilité ultime d’approuver les vaccins en fonction de leur innocuité et de leur efficacité. Une fois qu’un vaccin est utilisé dans le grand public, on continue de le surveiller pour en détecter les problèmes d’innocuité et les manifestations indésirables.
Les essais cliniques initiaux d’un vaccin sont effectués sur des adultes en bonne santé, mais les scientifiques ont quand même besoin de comprendre l’effet du vaccin dans d’autres populations ou groupes d’âge. Lorsque l’organisme de réglementation national a donné son approbation, des personnes enceintes, des personnes immunodéprimées, des adultes ayant d’autres maladies sous-jacentes et des enfants et adolescents peuvent être étudiés lors d’essais cliniques. Pour détecter les manifestations très rares, il faut des populations plus nombreuses que celles qui ont été étudiées durant les essais cliniques. C’est l’une des raisons pour lesquelles la surveillance de l’innocuité est effectuée après que le vaccin est offert à la population générale.
Les systèmes de surveillance de la santé publique
Les systèmes de surveillance de la santé publique sont les « antennes » des autorités de santé publique. Quand un nouveau vaccin est utilisé, ces systèmes détectent toute manifestation postvaccinale indésirable d’importance particulière. Les vaccins contre la COVID-19 ne font pas exception! Des organismes de santé publique nationaux et internationaux ont préparé des lignes directrices et des stratégies pour qu’une surveillance rigoureuse de l’innocuité des vaccins contre la COVID-19 soit correctement effectuée.
Surveillance passive
Les systèmes de surveillance passive sont le moyen le plus efficace par rapport au coût de surveiller les manifestations indésirables. Il est recommandé à tous les pays d’utiliser des systèmes de surveillance passive pour recueillir les déclarations de MAPI des fournisseurs de soins de santé, des fabricants de vaccins et du public. Ces déclarations sont ensuite compilées et analysées pour repérer tout problème d’innocuité du vaccin. Cela inclurait par exemple un trouble médical déclaré plus souvent qu’on ne s’y attend après la vaccination.
Surveillance active
La surveillance active peut être beaucoup plus dispendieuse. Il est aussi recommandé aux pays qui en ont les moyens d’établir des systèmes de surveillance active qui recherchent les cas de manifestations postvaccinales indésirables d’importance particulière. Les manifestations indésirables de cette nature peuvent inclure les crises épileptiques, le syndrome de Guillain-Barré, les caillots sanguins (ou thromboses) et d’autres. Les systèmes de surveillance active de la santé publique comparent aussi la présentation de ces troubles dans les groupes vaccinés et non vaccinés pour voir si la MAPI a été causée par le vaccin même ou s’il s’agit d’une simple coïncidence.
La surveillance passive et active des manifestations postvaccinales indésirables doit faire l’objet d’analyses de causalité : est-ce le vaccin ou la procédure d’immunisation qui cause la manifestation, ou s’agit-il d’un événement fortuit? Cette analyse doit être rigoureuse et scientifique, et elle est effectuée pour toutes les MAPI graves, comme les hospitalisations, les décès, etc. Attention : il y a une différence entre « grave » et « sévère ».

Complément d’information pour les fournisseurs de soins de santé
En décembre 2020, le Comité consultatif mondial sur la sécurité des vaccins de l’Organisation mondiale de la Santé et un consortium international de spécialistes de l’innocuité des vaccins, la Collaboration Brighton, se sont joints à la Coalition for Epidemic Preparedness Innovations (Coalition pour les innovations en matière de préparation aux épidémies), ou CEPI, pour établir des lignes directrices et des définitions de cas pour la surveillance de l’innocuité des vaccins contre la COVID-19. Le guide COVID-19 Vaccine Safety Guidance Manual publié par l’Organisation mondiale de la Santé comporte aussi des outils de surveillance de l’innocuité des vaccins.
Références
Brighton Collaboration. Brighton Collaboration is working diligently to fight the coronavirus disease (COVID-19) pandemic. SPEAC – a CEPI Project. The Task Force for Global Health; 2022. Consulté le 11 juillet 2022. https://brightoncollaboration.us/covid-19/
Département Vaccins et produits biologiques. Global vaccine safety blueprint. Genève : Organisation mondiale de la Santé; 2012. Consulté le 5 octobre 2020. https://www.who.int/vaccine_safety/publications/en/
Nsubuga P, White ME, Thacker SB, et al. Public health surveillance: a tool for targeting and monitoring interventions. [chapitre 53]. Dans : Disease control priorities in developing countries. 2e éd. Washington (DC) : Banque internationale pour la reconstruction et le développement/Banque mondiale; New York : Oxford University Press; 2006.
Comité consultatif mondial pour la sécurité des vaccins, 27-28 mai 2020. Relevé épidémiologique hebdomadaire 2020;95:325-36. Consulté le 5 octobre 2020. https://apps.who.int/iris/bitstream/handle/10665/333136/WER9528-eng-fre.pdf
Les vaccins contre la COVID-19 sont-ils sûrs pendant la grossesse et pour les personnes qui songent à devenir enceintes?
Les vaccins contre la COVID-19 sont sûrs avant et pendant la grossesse.
Ce qu’il faut savoir
- Les vaccins contre la COVID-19 sont sûrs et recommandés avant et pendant la grossesse.
- Les vaccins contre la COVID-19 préviennent efficacement la maladie grave, l’hospitalisation et la mort chez les personnes enceintes.
- L’infection par la COVID-19 pendant la grossesse peut entraîner un accouchement prématuré, l’accouchement d’un enfant mort-né et le décès
- La vaccination contre la COVID-19 protège contre la possibilité de devenir gravement malade pendant la grossesse et d’avoir un bébé né avant terme.
Innocuité et efficacité des vaccins contre la COVID-19 pendant la grossesse
Rien n’indique que les vaccins contre la COVID-19 pose un risque pour la grossesse ou le fœtus. En effet, les vaccins contre la COVID-19 ne contiennent pas le virus actif qui cause la maladie. Cela veut dire que les vaccins contre la COVID-19 ne peuvent pas causer d’infection chez les personnes enceintes ou leurs bébés.
Les vaccins suivants contre la COVID-19 actuellement utilisés au Canada ont été approuvés pour utilisation chez les personnes enceintes (et celles qui essaient de le devenir) :
- Le vaccin Pfizer-BioNTech
- Le vaccin Moderna Spikevax
- Le vaccin AstraZeneca Vaxzevria
- Le vaccin Janssen (Johnson & Johnson) Jcovden
- Le vaccin Novavax Nuvaxovid
Les avantages de la vaccination pendant la grossesse en surpassent les risques potentiels. En fait, la grossesse pose un plus grand risque de maladie grave causée par le virus de la COVID-19. Les vaccins contre la COVID-19 offrent une protection solide. Ils sont particulièrement recommandés pour les personnes enceintes vivant dans des communautés où la transmission du virus de la COVID-19 est élevée et pour celles dont le risque individuel d’exposition ou de maladie grave est plus élevé. Le fait d’avoir un trouble de santé préexistant, un système immunitaire affaibli ou d’exercer une profession où l’on a affaire avec le public lorsqu’on est enceinte sont des exemples de risque individuel élevé.
Les vaccins approuvés contre la COVID-19 s’avèrent tout aussi efficaces chez les personnes enceintes que chez celles qui ne le sont pas. Ils préviennent très efficacement la maladie grave, les hospitalisations et les décès dus à la COVID-19 pendant la grossesse. Certaines études montrent aussi que les anticorps contre le virus de la COVID-19 peuvent être transférés au fœtus par le cordon ombilical. Cela signifie que la vaccination pendant la grossesse peut aussi protéger le bébé contre la COVID-19.
Le Comité consultatif national de l’immunisation (CCNI) recommande que les personnes enceintes soient vaccinées contre la COVID-19. De plus, les personnes enceintes et celles qui allaitent devraient recevoir un rappel du vaccin contre la COVID-19, peu importe le nombre de doses qu’elles ont reçues auparavant (ou le stade de la grossesse).
Les personnes enceintes et leurs bébés courent un plus grand risque
Les personnes enceintes courent un plus grand risque de contracter la maladie grave due à la COVID-19 et sont plus susceptibles d’être hospitalisées et de nécessiter des soins intensifs ou un respirateur artificiel pour cette raison. Elles courent un plus grand risque de mourir de la COVID-19 (pendant la grossesse ou peu après avoir donné naissance).
Toutes les personnes enceintes courent un plus grand risque de complications de santé dues à la COVID19. Cependant, chez celles qui ont plus de 35 ans, qui sont en surpoids et/ou qui ont un trouble de santé préexistant (comme le diabète ou l’hypertension artérielle), le risque est encore plus élevé.
Les personnes enceintes infectées par la COVID19 courent aussi un plus grand risque de donner naissance prématurément. Un accouchement prématuré accroît le risque que le bébé ait besoin de soins intensifs. Il accroît aussi le risque que le bébé soit mort-né.
La vaccination contre la COVID-19 pour les personnes qui essaient de devenir enceintes
Les personnes qui essaient de devenir enceintes peuvent recevoir les vaccins contre la COVID-19. Comme le risque de maladie grave due à la COVID-19 est plus élevé pendant la grossesse, il est vivement recommandé aux personnes qui essaient de devenir enceintes de se faire vacciner avant pour mieux se protéger, ainsi que leurs bébés.
La vaccination contre la COVID-19 n’a aucun effet sur la fécondité ni la capacité de devenir enceinte. De plus, les essais cliniques ont montré que les personnes vaccinées sont tout aussi susceptibles de concevoir que les personnes non vaccinées.
L’Organisation mondiale de la santé ne recommande pas de reporter ou de terminer la grossesse en raison de la vaccination contre la COVID-19. Il n’est pas nécessaire non plus de subir un test de grossesse avant de recevoir un vaccin contre la COVID19.
Complément d’information pour les prestataires de soins de santé
La surveillance sanitaire des personnes enceintes effectuée depuis février 2022 dans plusieurs pays ne fait état d’aucune préoccupation liée à la grossesse quant à l’innocuité des vaccins contre la COVID-19. Par exemple :
- Aux États-Unis, plus de 198 000 personnes enceintes ont été suivies, dont la plupart ont reçu le vaccin Pfizer ou Moderna contre la COVID-19. Aucune différence n’a été constatée dans les taux de naissances avant terme, d’accouchements de mort-nés et de fausses couches entre les personnes enceintes vaccinées et non vaccinées.
- Au Royaume-Uni, plus de 100 000 personnes enceintes ont été suivies, dont la plupart ont reçu des vaccins à ARNm contre la COVID-19. Aucune différence n’a été constatée dans les résultats de santé maternels et les issues de la grossesse entre les personnes enceintes vaccinées et non vaccinées.
- Au Brésil, plus d’1 million de personnes enceintes ont été suivies, dont la plupart ont reçu le vaccin Pfizer contre la COVID-19 (et une petite portion ont reçu le vaccin AstraZeneca contre la COVID-19). Jusqu’à maintenant, aucun problème d’innocuité spécifiquement lié à la grossesse n’a été constaté.
Des essais cliniques de plusieurs vaccins contre la COVID-19 chez des personnes enceintes sont en cours ou en projet, et la surveillance des personnes ayant reçu des vaccins pendant la grossesse, et de leurs bébés, se poursuit.
Des études sur les animaux appelées DART (études sur la toxicité pour la reproduction et le développement) n’ont pas non plus montré d’effets néfastes sur les femelles gravides et leurs petits.
Références
Allotey J, Stallings E, Bonet M, et al. Clinical manifestations, risk factors, and maternal and perinatal outcomes of coronavirus disease 2019 in pregnancy: living systematic review and meta-analysis. BMJ 3 sept. 2020 révisé le 10 mars 2021;370:m3320. doi:10.1136/bmj.m3320.
Ciapponi A, Bardach A, Mazzoni A, et al. Safety of components and platforms of COVID-19 vaccines considered for use in pregnancy: a rapid review. Vaccine 6 juin 2021;39(40):5891–908. doi:10.1101/2021.06.03.21258283.
COVID-19 Vaccine Surveillance Report – Week 6. Londres : UK Health Security Agency; 10 févr. 2022. https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/1054071/vaccine-surveillance-report-week-6.pdf
Dagan N, Barda N, Biron-Shental T, et al. Effectiveness of the BNT162b2 mRNA COVID-19 vaccine in pregnancy. Nat Med 9 sept. 2021;27(10):1693–5. doi:10.1038/s41591–021–01490–8.
Fu W, Sivajohan B, McClymont E, et al. Systematic review of the safety, immunogenicity, and effectiveness of COVID-19 vaccines in pregnant and lactating individuals and their infants. Int J Gynaecol Obstet 5 nov. 2021. doi:10.1002/ijgo.14008.
Hillson K, Clemens SC, Madhi SA, et al. Fertility rates and birth outcomes after ChAdOx1 nCoV-19 (AZD1222) vaccination. Lancet 21 oct. 2021;398(10312):1683–4. doi:10.1016/S0140-6736(21)02282-0.
Recommandations provisoires pour l’utilisation du vaccin anti-COVID-19 BBV152 COVAXIN® de Bharat Biotech : orientations provisoires, première publication le 3 novembre 2021, mise à jour le 15 mars 2022. Genève : Organisation mondiale de la santé; 2021. https://apps.who.int/iris/handle/10665/353402
Kharbanda EO, Haapala J, DeSilva M, et al. Spontaneous abortion following COVID-19 vaccination during pregnancy. JAMA 9 sept. 2021;326(16):1629-31. doi:10.1001/jama.2021.15494.
Comité consultatif national de l’immunisation (CCNI). Directives mises à jour sur les vaccins contre la COVID-19 chez les personnes enceintes ou qui allaitent. Déclaration du comité consultatif (DCC); 9 sept. 2022. https://www.canada.ca/content/dam/phac-aspc/documents/services/immunization/national-advisory-committee-on-immunization-naci/directives-mises-jour-vaccins-contre-covid-19-personnes-enceintes-allaitent.pdf
Observatório Obstétrico Brasileiro COVID-19 Vacinação; 2022. Consulté le 11 février 2022 sur https://observatorioobstetrico.shinyapps.io/vacinacaocovid19/.
Shimabukuro TT, Kim SY, Myers TR, et al. Preliminary findings of mRNA Covid-19 vaccine safety in pregnant persons. N Engl J Med 22 avril 2021;384(24):2273–82. doi:10.1056/NEJMoa2104983.
Villar J, Ariff S, Gunier RB, et al. Maternal and neonatal morbidity and mortality among pregnant women with and without COVID-19 infection: the INTERCOVID multinational cohort study. JAMA Pediatr 23 avril 2021;175(8):817–26. doi:10.1001/jamapediatrics.2021.1050.
Wei SQ, Bilodeau-Bertrand M, Liu S, et al. The impact of COVID-19 on pregnancy outcomes: a systematic review and meta-analysis. CMAJ 21 mars 2021;193(16):E540–8. doi:10.1503/cmaj.202604.
Wesselink AK, Hatch EE, Rothman KJ, et al. A prospective cohort study of COVID-19 vaccination, SARS-CoV-2 infection, and fertility. Am J Epidemiol 22 janv. 2022. doi:10.1093/aje/kwac011.
Zauche LH, Wallace B, Smoots AN, et al. Receipt of mRNA Covid-19 vaccines and risk of spontaneous abortion. N Engl J Med 9 sept. 2021;385(16):1533–5. doi:10.1056/NEJMc2113891.
Les vaccins contre la COVID-19 fonctionnent-ils chez les patients immunodéprimés ou séropositifs pour le VIH?
Les vaccins contre la COVID-19 peuvent être administrés à ces patients.
Ce qu’il faut savoir
- Les personnes vivant avec le VIH ou immunodéprimées sont plus à risque de contracter la maladie grave due à la COVID-19.
- L’immunisation contre la COVID-19 est recommandée aux patients séropositifs pour le VIH et immunodéprimés.
- D’autres mesures de prévention de la COVID-19 sont hautement recommandées aux personnes dont le VIH est mal contrôlé et à ceux qui sont sévèrement immunodéprimés.
Les vaccins contre la COVID-19 chez les personnes séropositives pour le VIH
Au début de la pandémie de COVID-19, différentes catégories de vaccins ont été rapidement mises au point, ce qui a soulevé des inquiétudes quant à l’utilisation de certains vaccins contre la COVID-19 chez les personnes vivant avec le VIH. En effet, le VIH est une maladie virale qui tue des globules blancs, les lymphocytes CD4, ce qui affaiblit le système immunitaire.
Les données sur l’innocuité des vaccins contre la COVID-19 chez les patients dont le VIH est bien contrôlé sont limitées, mais celles que nous avons jusqu’à maintenant sont rassurantes. Voici des informations sur les trois vaccins contre la COVID-19 approuvés au Canada pour les personnes vivant avec le VIH :
- Vaccin Pfizer-BioNTech : aucun problème d’innocuité n’a été déclaré chez les patients dont le VIH est bien contrôlé.
- Vaccin Moderna : même information que pour le vaccin Pfizer-BioNTech.
- Vaccin Janssen (Johnson & Johnson) : aucun problème d’innocuité additionnel n’a été détecté dans les grands essais cliniques ayant des participants dont le VIH était bien contrôlé.
Nous manquons de données sur l’innocuité et l’efficacité des vaccins contre la COVID-19 chez les patients dont le VIH est mal contrôlé. En juillet 2021, le Groupe stratégique consultatif d’experts (SAGE) de l’Organisation mondiale de la santé (OMS) a élaboré un document d’orientation intérimaire qui indique que les données disponibles sont trop rares pour bien évaluer l’efficacité potentielle ou l’innocuité des vaccins pour les personnes dont le VIH est mal contrôlé.
Les vaccins contre la COVID-19 chez les personnes immunodéprimées
Nous manquons de données sur l’innocuité et l’efficacité des vaccins contre la COVID-19 utilisés au Canada pour les personnes immunodéprimées. L’une des difficultés de la collecte de ces données est qu’il s’agit d’un groupe très disparate. Par exemple, une personne peut être immunodéprimée en raison d’une maladie qui affecte son système immunitaire ou parce qu’elle prend des médicaments immunosuppresseurs pour traiter un trouble médical. C’est pourquoi le SAGE de l’OMS a indiqué qu’en raison de la rareté des données disponibles, il n’est pas possible d’évaluer complètement l’innocuité des vaccins contre la COVID-19 ou les risques qu’ils pourraient poser pour les personnes immunodéprimées. Le SAGE indique aussi que chez ces personnes, la réponse immunitaire au vaccinpeut être réduite, ce qui en retour réduirait l’efficacité du vaccin En réalité, les vaccins contre la COVID-19 semblent être inefficaces chez les greffés, car leur système immunitaire est sévèrement affaibli par les médicaments pour éviter le rejet des tissus transplantés.
Les personnes immunodéprimées appartenant à l’un des groupes pour qui l’immunisation contre la COVID-19 est recommandée devraient être vaccinées.
D’autres mesures de prévention sont hautement recommandées
Même si une personne séropositive pour le VIH ou immunodéprimée a reçu toutes les doses d’un vaccin contre la COVID-19, d’autres mesures de prévention sont vivement recommandées. En effet, les vaccins contre la COVID-19 peuvent ne pas être aussi efficaces chez les personnes sévèrement immunodéprimées ou dont le VIH est mal contrôlé. Ces autres mesures de prévention sont :
On trouvera de plus amples informations sur la prévention et les risques de la COVID-19 sur https://www.canada.ca/fr/sante-publique/services/maladies/2019-nouveau-coronavirus/prevention-risques.html
Complément d’information pour les fournisseurs de soins de santé
Le SAGE de l’OMS sur l’immunisation a préparé un document d’orientation sur les vaccins contre la COVID-19 à l’usage des responsables des politiques.
Références
Coburn SB, Humes E, Lang R, Stewart C, Hogan BC, et al. 2022. Analysis of postvaccination breakthrough COVID-19 infections among adults with HIV in the United States. JAMA Netw Open, 1er juin 2022;5(6): e2215934. doi:10.1001/jamanetworkopen.2022.15934. Consulté le 5 octobre 2022 sur https://pubmed.ncbi.nlm.nih.gov/35671054/.
Nault L, Marchitto L, Goyette G, Tremblay-Sher D, Fortin C, et al. 2022. Covid-19 vaccine immunogenicity in people living with HIV-1. Vaccine 9 juin 2022;40(26):3633–7. doi:10.1016/j.vaccine.2022.04.090. Consulté le 5 octobre 2022 sur https://pubmed.ncbi.nlm.nih.gov/35568588/.
Organisation mondiale de la santé (OMS). 2021. Interim recommendations for an extended primary series with an additional vaccine dose for COVID-19 vaccination in immunocompromised persons. Interim Guidance. Agenda, Policy & Strategy, Immunization, Vaccines and Biologicals, Strategic Advisory Group of Experts on Immunization, WHO Headquarters (HQ); 25 octobre 2021. Consulté le 5 octobre 2022 sur https://www.who.int/publications/i/item/WHO-2019-nCoV-vaccines-SAGE_recommendation-immunocompromised-persons.
Les contributeurs
Sonali Kochhar, M.D.1, Ève Dubé, Ph.D.2, Janice Graham, Ph.D.3, Youngmee Jee M.D., Ph.D.4, Ziad A. Memish, M.D.5, Lisa Menning6, Hanna Nohynek, M.D., Ph.D.7, Daniel Salmon, Ph.D.8; Karina Top, M.D., M.S.9, Noni E MacDonald, M.D.10
Affiliations et conflit d'intérêts (CI)
-
Professeure agrégée de clinique, Département de santé mondiale, Université de Washington, Seattle; directrice médicale, Global Healthcare Consulting
CI - Rien à déclarer -
Recherchiste en chef à l’Institut national de la santé publique du Québec; professeure invitée d’anthropologie, Université Laval, Canada
CI - Rien à déclarer -
Professeure-chercheuse universitaire et professeure de pédiatrie (maladies infectieuses) et d’anthropologie, Université Dalhousie, Canada
CI - Rien à déclarer -
Professeure visiteuse, ESP, Université nationale de Séoul; représentante spéciale pour la diplomatie sanitaire, Korea Foundation
CI - Rien à déclarer -
Conseiller principal en maladies infectieuses, directeur du Centre de recherche et d’innovation, King Saud Medical City, ministère de la Santé, Riyad, Arabie saoudite
CI - Rien à déclarer -
Agente technique, OMS QG Département de vaccination, vaccins et produits biologiques, Genève
CI - Rien à déclarer -
Médecin-chef, chef d’unité adjointe, Institut national pour la santé et le bien-être THL, Finlande
CI – L’Institut THL a une stratégie de partenariat public-privé : ni moi, ni mon unité recevons ces subventions privées -
Directeur et professeur, Institute of Vaccine Safety, Université Johns Hopkins École de santé publique, États-Unis
CI – L’Institut THL a une stratégie de partenariat public-privé : ni moi, ni mon unité recevons ces subventions privées -
Professeure agrégée de pédiatrie et de santé communautaire & épidémiologie, Université Dlahousie, Canada
CI – L’Institut THL a une stratégie de partenariat public-privé : ni moi, ni mon unité recevons ces subventions privées -
Professeure de pédiatrie, Université Dalhousie, IWK Health Centre, Canada
CI - Rien à déclarer
Le groupe de travail (GT) INNOVAC
Étant donné l’importance critique des vaccins contre la COVID-19 et la nécessité de connaître leur innocuité, le groupe de travail (GT) INNOVAC (INNOcuité des VAccins contre la COVID-19) a été créé en septembre 2020.
Le GT INNOVAC vise à fournir des réponses claires et complètes aux questions sur l’innocuité des vaccins contre la COVID-19 avant et pendant leur déploiement pour : 1) faciliter les discussions scientifiques entre les acteurs, notamment les agents de santé de première ligne, et les personnes à vacciner; et 2) améliorer la clarté et la transparence des informations afin de favoriser l’acceptation et l’adoption des vaccins.
Les vaccins contre la COVID-19 susciteront probablement des réserves, vu leur mise au point accélérée, la méfiance devant la riposte des gouvernements à la pandémie et la suspicion croissante à l’égard des vaccins dans certaines populations1-4. Comme pour tout autre nouveau vaccin, il est possible que des réactions indésirables rares ne soient pas détectées lors des essais cliniques et qu’elles ne se manifestent qu’après la vaccination d’un grand nombre de personnes. De plus, quand de très nombreuses personnes sont vaccinées, certaines éprouvent des résultats sanitaires indésirables peu après la vaccination par le seul fait du hasard. Les réserves quant à l’innocuité des vaccins contre la COVID-19 doivent donc être abordées d’urgence. Le groupe INNOVAC a été créé pour fournir aux acteurs privilégiés des réponses claires et accessibles aux questions courantes sur l’innocuité des vaccins contre la COVID-19.
Chaque réponse est rédigée par un membre expert du GT et examinée par deux autres membres ou plus.
La science évolue rapidement. Quand d’autres questions seront portées à l’attention du groupe et que d’autres informations deviendront disponibles (après les essais cliniques des vaccins contre la COVID-19 et les premières expériences d’introduction des vaccins dans certains pays), les réponses seront actualisées, et de nouvelles réponses seront publiées. Les questions et leurs réponses sont hébergées sur la présente page et comportent des renvois vers d’autres sites.
Les informations sur cette page sont rédigées par un groupe international d’experts en immunisation et sont valables à l’échelle mondiale, notamment dans le contexte canadien.
Vous trouverez ci-dessous la dernière version des réponses fournies. Cette page Web sera actualisée quand de nouvelles réponses s’ajouteront.
Références
- Schaffer DeRoo S, Pudalov NJ, Fu LY. Planning for a COVID-19 Vaccination Program. JAMA 2020; 323(24):2458-2459. doi:10.1001/jama.2020.8711
- Lancet COVID-19 Commissioners, Task Force Chairs, and Commission Secretariat. Lancet COVID-19 Commission Statement on the occasion of the 75th session of the UN General Assembly. Lancet 2020; S0140-6736(20):31927-9. doi: 10.1016/S0140-6736(20)31927-9
- Kochhar S, Salmon DA. Planning for COVID-19 vaccines safety surveillance. Vaccine 2020 Sep 11;38(40):6194-6198. doi: 10.1016/j.vaccine.2020.07.013
- MacDonald NE, Dubé È. Vaccine safety concerns: Should we be changing the way we support immunization? EClinicalMedicine 2020 Jun; 23:100402. doi: 10.1016/j.eclinm.2020.100402
