Preguntas y respuestas sobre las vacunas frente a COVID-19 para sanitarios
Spanish Translation by Dr José A. Navarro-Alonso, MD
Email: janavarroalonso@gmail.com
Sonali Kochhar, MD1, Eve Dubé, PhD2, Janice Graham, PhD3, Youngmee Jee MD, PhD4, Ziad A. Memish, MD5, Lisa Menning6, Hanna Nohynek, MD, PhD7, Daniel Salmon, PhD8; Karina Top, MD, MS9, Noni E MacDonald, MD10
Afiliaciones y conflicto de intereses
-
Clinical Associate Professor, Department of Global Health, University of Washington, Seattle; Medical Director, Global Healthcare Consulting
COI - Nothing to declare -
Senior researcher at Quebec National Institute of Public Health; Invited Professor in Anthropology, Laval University, Canada
COI - Nothing to declare -
University Research Professor and Professor of Pediatrics (Infectious Diseases) and Anthropology, Dalhousie University, Canada
COI - Nothing to declare -
Visiting Professor, GSPA, Seoul National University; Special Representative for Health Diplomacy, Korea Foundation
COI - Nothing to declare -
Senior Infectious Disease Consultant, Director Research and Innovation Center, King Saud Medical City, Ministry of Health, Riyadh, Saudi Arabia
COI- Nothing to declare -
Technical Officer, WHO HQ Department of Immunization, Vaccines, and Biologicals, Geneva
COI - Nothing to declare -
Chief Physician, Deputy Head of Unit, Finnish Institute for Health and Welfare THL, Finland
COI - My institute THL has got a strategy of public private partnership; neither myself nor my unit receives such private funds/grants. -
Director and Professor, Institute for Vaccine Safety, Johns Hopkins University School of Public Health, United States
COI - Consulting and/or grants with Merck, Jenssen and Walgreens. -
Associate Professor of Pediatrics and Community Health & Epidemiology, Dalhousie University, Canada
COI - In the past 3 years I have received consultancy fees from Pfizer and grants from GSK to my institution for projects unrelated to this work. -
Professor Paediatrics, Dalhousie University, IWK Health Centre, Canada
COI- Nothing to declare
El Grupo de Trabajo (GT) CONSIDER
El Grupo de Trabajo (GT) the CONSIDER (COvid-19 vacciNe Safety questIons anD hEalthcare pRoviders) se creó en septiembre de 2020 para reconocer la crítica importancia de las vacunas frente a COVID-19 y la necesidad de entender acerca de su seguridad.
El CONSIDER GT tiene como objetivo proporcionar respuestas claras e integrales a las preguntas referentes a la seguridad de las vacunas frente a COVID-19, antes y durante el proceso de implantación para:
1) facilitar la discusión científica entre los interesados, incluyendo a los sanitarios de primera línea que sean potenciales candidatos a vacunar, y
2) mejorar la comprensión y la transparencia de la información al objeto de facilitar la aceptación y la captación de la vacuna.
Es muy probable que haya dudas motivadas porque las vacunas frente a COVID-19 se han desarrollado muy rápidamente, por la desconfianza hacia la respuesta pandémica que han dado los gobiernos y a la creciente sospecha de algunos grupos de población hacia las vacunas.1-4 Al igual que pasa con las nuevas vacunas, cabe la posibilidad de que no se identifiquen en los ensayos clínicos las reacciones adversas muy infrecuentes, y que solo se detectarán una vez que se haya vacunado una importante parte de la población. Adicionalmente, al vacunar a un número alto de ciudadanos, varios tendrán, casualmente, algún problema de salud al poco de vacunarse. Ello implica que las dudas o preocupaciones en relación a la seguridad de las vacunas deben de abordarse inmediatamente. El grupo CONSIDER se constituyó para dar respuestas a las preguntas más comunes relacionadas con la seguridad de las vacunas COVID-19 que sean comprensibles y accesibles a los principales interesados.
Cada respuesta está elaborada por un experto, miembro del Grupo de Trabajo, y revisada por dos o más miembros del Grupo.
La ciencia evoluciona con rapidez. A medida que aumentan las preguntas que atraen la atención del Grupo o que se dispone de más información (procedente de los ensayos clínicos de la vacuna o de la experiencia inicial derivada de la introducción de la vacuna a escala poblacional), las respuestas se actualizarán y se colgarán las respuestas nuevas. Las preguntas y respuestas estarán alojadas en la web (https://canvax.ca/covid-19-vaccine-questions-and-answers-healthcare-providers) y estarán referenciadas en otras páginas web.
La información que proporciona esta página web está elaborada por un grupo de expertos en vacunación y es de aplicación universal que incluye el contexto canadiense.
Más abajo dispone de la última versión de las respuestas. Esta página web se actualizará y se añadirán nuevas respuestas.
Referencias
- Schaffer DeRoo S, Pudalov NJ, Fu LY. Planning for a COVID-19 Vaccination Program. JAMA. 2020; 323(24):2458-2459. doi:10.1001/jama.2020.8711
- Lancet COVID-19 Commissioners, Task Force Chairs, and Commission Secretariat. Lancet COVID-19 Commission Statement on the occasion of the 75th session of the UN General Assembly. Lancet. 2020:S0140-6736(20)31927-9. doi: 10.1016/S0140-6736(20)31927-9.
- Kochhar S, Salmon DA. Planning for COVID-19 vaccines safety surveillance. Vaccine. 2020 Sep 11;38(40):6194-6198. doi: 10.1016/j.vaccine.2020.07.013
- MacDonald NE, Dube E. Vaccine safety concerns: Should we be changing the way we support immunization? EClinicalMedicine. 2020 Jun; 23:100402. doi: 10.1016/j.eclinm.2020.100402.
Preguntas y respuestas sobre las vacunas frente a COVID-19 para sanitarios
En relación a los ensayos clínicos
¿Pueden las vacunas de ARNm generar modificaciones genéticas en los humanos?, ¿hay otros problemas de seguridad con esas vacunas?
Sonali Kochhar y el equipo de preguntas y respuestas
Las vacunas de ARN mensajero (ARNm) consisten en piezas sintéticas de ácido ribonucleico encapsuladas en una nanopartícula de lípidos para facilitar la entrada en las células del huésped. Estas vacunas no están constituidas por virus vivos. La nanopartícula lipídica tiene un efecto estabilizador y adyuvante y la vacuna no contiene adyuvantes adicionales que mejoren la eficacia de la vacuna1. Las vacunas ARNm no entran al núcleo y por tanto no pueden integrarse en el ADN del humano ni originar cambios en el ADN del humano que las recibe1,2,3,4.
Tras la inyección intramuscular en el hombro, las vacunas de ARNm frente a COVID-19 darán instrucciones a las células para que fabriquen piezas de proteínas llamadas “espículas”, que por sí mismas no pueden causar enfermedad. Estas proteínas en su estado natural se encuentran en la superficie del virus que causa COVID-19. Una vez fabricadas, las células destruyen el ARNm en unos días1,2,3.
Las proteínas se sitúan en la superficie de la célula donde el sistema inmune las reconoce como ajenas a la célula y comienza el proceso de producción de anticuerpos construyendo una respuesta inmune- de células B y T- exactamente igual a lo que ocurre tras la infección natural por COVID-19. De esta manera, el organismo aprende a protegerse frente a infecciones futuras sin el riesgo de padecer las graves consecuencias de la infección por el virus.
El ARN mensajero es, intrínsecamente, un vector seguro para una vacuna ya que su vida media es muy corta y transporta una cantidad mínima de información que no interacciona con el ADN de la persona vacunada. La no integración en el genoma del huésped junto a no replicarse y a ser degradado metabólicamente en unos pocos días hace del ARN mensajero un transportador de información transitorio y seguro2,3.
Las vacunas de ARN mensajero ya se han estudiado anteriormente a propósito de las vacunas del virus Zika, de la rabia, de la gripe y del citomegalovirus1,4. La investigación del cáncer también se ha beneficiado del ARN mensajero a la hora de promover que el sistema inmune reaccione frente a células cancerosas específicas1,4. En un futuro, la tecnología de ARN mensajero permitirá que una vacuna proteja frente a varias enfermedades, lo que disminuiría el número de pinchazos que se precisarían para defenderse de esas enfermedades1. El proceso de producción de vacunas de ARN mensajero -rápido y a gran escala- y la formulación en nanopartículas permite una veloz producción de muchas dosis de vacuna2,3; ello permite que esa tecnología sea muy útil para elaborar vacunas con gran rapidez en caso de una pandemia5. Las vacunas de ARNm ofrecen una flexibilidad máxima en su proceso de desarrollo ya que puede expresar cualquier proteína sin la necesidad de ajustar el proceso de producción3.
Debido a su composición precisa de unas medidas restrictivas de almacenamiento y manejo de manera que se garantice la estabilidad de la molécula de ARNm. Por ejemplo, la vacuna de Pfizer, BNT162b2, se debe almacenar entre -80ºC y -60ºC (-112ºF a -76ºF) y después de descongelarla y diluirla y antes de administrarla se debe almacenar entre 2ºC y 25ºC (35ºF a 77ºF) para administrarla en las seis horas siguientes a la dilución. Por su parte, la vacuna de ARN de Moderna, mRNA-1273, tiene que almacenarse a -20ºC (-4ºF) con una duración de hasta seis meses. Después del descongelado se mantiene la estabilidad entre 2ºC y 8ºC (36ºF a 46ºF) hasta treinta días. Con el tiempo la tecnología conseguirá superar este aspecto, pero de momento esta circunstancia limita el acceso y uso de la vacuna en muchos lugares que no pueden acceder a un ultracongelador. Las vacunas de ARNm suponen un avance impresionante que cambiará, no muy tarde, el panorama de la Vacunología.
Referencias
- Understanding mRNA COVID-19 Vaccines. Centres for Disease Control and prevention. Nov. 23, 2020. Accessed on 14 Dec 2002 at https://www.cdc.gov/coronavirus/2019-ncov/vaccines/different-vaccines/mrna.html
- Advances in mRNA Vaccines for Infectious Diseases. Zhang C, Maruggi G, Shan H, Li J. Front Immunol. 2019;10:594. doi: 10.3389/fimmu.2019.00594.
- Developing mRNA-vaccine technologies. Schlake T, Thess A, Fotin-Mleczek M, Kallen KJ. RNA Biol. 2012; 9(11):1319-1330. doi:10.4161/rna.22269
- mRNA vaccines - a new era in vaccinology. Pardi N, Hogan MJ, Porter FW, Weissman D. Nat Rev Drug Discov. 2018;17(4):261-279. doi:10.1038/nrd.2017.243
¿Cómo se conoce la seguridad de una vacuna antes de que se comercialice?
Eve Dubé y el Equipo de preguntas y respuestas
Al contrario de los medicamentos, que se administran para curar a personas enfermas, las vacunas se dan a personas sanas para evitar que enfermen. Por tanto, respecto de las medicinas, precisan de unas garantías mayores de seguridad antes de su comercialización. El desarrollo de una vacuna pasa por unos rigurosos procesos científicos y éticos a la vez que se somete a unos procedimientos que aseguran su seguridad y eficacia antes de que se utilicen masivamente (ver MacDonald y Law1, acerca del sistema canadiense de seguridad de las vacunas, que es muy similar al utilizado en muchos otros países).
En primer lugar, se evalúa la seguridad y la inmunogenicidad de la vacuna (esto es, la capacidad de producir una respuesta inmune) en los estudios preclínicos que utilizan cultivo de tejidos, cultivos celulares o modelos animales (por ejemplo, ratones, hurones o monos). Si proporcionan resultados satisfactorios estos estudios tanto en la seguridad como en la inmunogenicidad, se pasa a los estudios clínicos en humanos. En cada fase de ellos, las agencias regulatorias de los países evalúan los datos de los estudios para permitir el paso a la fase siguiente.
La fase I incluye a un pequeño grupo de adultos, generalmente entre 10 y 100 adultos sanos, y su objetivo es evaluar la seguridad de la vacuna y el tipo y la magnitud de la respuesta inmune. Si en esta fase no se identifica nada anormal, la vacuna experimental progresa a la fase II que ya incluye a varios cientos de voluntarios. En esta fase se mide la seguridad, la inmunogenicidad, la dosis y el esquema de vacunación y si sale todo según lo previsto se pasa a la fase III en la que ya participan miles o decenas de miles de personas y en la que se estudia la eficacia y se recaban más datos sobre su seguridad. Estos datos se consiguen mediante ensayos clínicos aleatorios y doble ciego en los que la vacuna candidata se ensaya frente a un comparador o placebo -en general es una sustancia inerte o suero salino-. Estos ensayos permiten detectar efectos adversos infrecuentes – con una frecuencia inferior a 1 por 10.0002- que no se identificaron en las fases previas.2
La información sobre la seguridad y la eficacia obtenida en estos ensayos clínicos se evalúa por las agencias regulatorias de los países cuyos miembros son independientes respecto de los investigadores que llevaron a cabo los estudios o de la propia industria farmacéutica que los patrocina. A menudo, los datos los revisan, también, otros expertos ajenos a los regulatorios.Tras una cuidadosa revisión de los datos y tras aprobarse por las agencias, la vacuna puede utilizarse en el país. No obstante, una vez que ya ha sido aprobada, continúa la vigilancia de su seguridad mediante sistemas de vigilancia activa y pasiva para asegurar que se identificarán los posibles efectos adversos muy infrecuentes que pudieran asociarse a la vacuna (referencia a la última pregunta de la sección de efectos a largo plazo).
Incluso si el desarrollo de las vacunas frente a COVID-19 ha sido rápido, los estándares descritos también se aplican al desarrollo de las vacunas frente a COVID-19 (referencia a la pregunta 4)3. Muchas de las vacunas que se han desarrollado frente a COVID-19 utilizan tecnologías que ya se han mostrado seguras con otros fármacos o vacunas, otras utilizan novedosas tecnologías. Como con cualquier nueva vacuna, se presta especial atención a su seguridad.
Referencias
- MacDonald NE, Law BJ. Canada’s eight-component vaccine safety system: A primer for health care workers. Paediatrics & Child Health, 2017, e13-16 Online: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5825834/pdf/pxx073.pdf Page Accessed September 28, 2020
- Vaccine Testing and Approval Process. Centers for Disease Control and Prevention. Online: https://www.cdc.gov/vaccines/basics/test-approve.html Page Accessed on September 25, 2020
- Accelerating a safe and effective COVID-19 vaccine. World Health Organization. Online: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/accelerating-a-safe-and-effective-covid-19-vaccine Page Accessed on September 25, 2020
¿Qué es lo que garantiza la seguridad de una vacuna?
Janice Graham y el Equipo de Preguntas y Respuestas
Muchos controles (legales, regulatorios, guías) ayudan a asegurar que las vacunas aprobadas por las agencias regulatorias nacionales, del tipo de la Food and Drug Administration de los Estados Unidos, de Health Canada o de la Agencia Europea del Medicamento son seguras y eficaces. Estos organismos aprueban los ensayos clínicos y evalúan cuidadosamente las evidencias antes de que se apruebe una vacuna o un agente o dispositivo terapéutico. Los comités institucionales de ética en la investigación determinan si los protocolos de los ensayos clínicos cumplen con los estándares de ética en cuanto al consentimiento informado, a la capacidad de tomar decisiones, a cómo se llevan a cabo los ensayos, a la equidad en la participación, a la privacidad y confidencialidad, a los conflictos de intereses, a la monitorización y comunicación de los aspectos de la seguridad, y a su registro (en Canadá es competencia del Tri-Council Panel on Research Ethics). Las guías de las instituciones internacionales (por ejemplo, la International Conference on Harmonization of Good Clinical Practice) supervisan la investigación en humanos y las obligaciones del regulatorio en relación a la seguridad, eficacia y calidad.1
En cada ensayo clínico se constituye un comité de monitorización de la seguridad de los datos (Data Safety Monitoring Board) que es el responsable de llevar a cabo la evaluación provisional de los datos generados durante el ensayo y a unos intervalos predeterminados. El ensayo puede interrumpirse cuando aparece un efecto adverso e incluso paralizarlo por completo si su continuación se considera injustificada. La Organización Mundial de la Salud coordina a los paneles de expertos asesores encargados de deliberar en cuestiones de salud global, proporciona orientación ética y trabaja con las agencias regulatorias nacionales para autorizar el uso de vacunas seguras en países de baja renta. Alienta, además, a los países a contar con grupos de asesores técnicos en materia de vacunación (NITAG) cuyo objetivo sería revisar los datos de las vacunas aprobadas en relación a la epidemiología local al objeto de determinar quién, en su caso, debería recibir la vacuna. Los NITAG tienen la capacidad de crear estándares globales de seguridad de las vacunas.2,3
Respecto de la seguridad y desde la perspectiva de tener la confianza de la población, es crítica la transparencia a lo largo de todo el proceso previo a la aprobación de la vacuna que incluirá la revisión de todos los protocolos, los documentos técnicos, los estudios clínicos, las reglas de parada y los procesos de decisión.4,5 En caso de necesidades urgentes en el contexto de emergencias de salud pública, las agencias regulatorias nacionales pueden acelerar los pasos para que en base a los datos de los ensayos clínicos, consideren la aprobación condicional de una vacuna o un uso bajo situaciones de emergencia. A pesar de algunas presiones políticas, las agencias regulatorias de Canadá, los Estados Unidos y Europa se han resistido a tomar atajos. Una aprobación acelerada precisa de vigilancia que asegure que no se compromete la seguridad.6,7,8
Los estándares regulatorios y legales que limiten conflictos de intereses refuerzan la calidad de la fabricación y la declaración de los efectos adversos graves. En el caso de acelerar la aprobación de una vacuna y para infundir confianza a la población respecto de que será segura, la población precisa tener seguridad respecto a:
- Criterios claros para excluir a aquellas personas involucradas en la toma de decisiones que tengan conflictos de intereses personales o profesionales.
- Transparencia y libre acceso a todos los protocolos de los ensayos clínicos, a los datos (incluyendo a los componentes de la vacuna, como adyuvantes), a las enmiendas y adaptaciones y a los procesos de toma de decisiones y sus fundamentos.
- Que no se incremente el riesgo en los participantes cuando se introduzcan modificaciones para comprimir las fases de los ensayos clínicos o cuando se añada un nuevo brazo como respuesta a nuevos hallazgos. Si, tal como dice la Global Alliance for Vaccines and Immunization (GAVI), “estas modificaciones están basadas en reglas claramente definidas establecidas por científicos expertos en evaluar incertidumbres”, deberían hacerse públicas con carácter inmediato, por ejemplo, con transparencia, con fundamentos y con datos o evidencias que apoyen la decisión.
- La evaluación independiente de la evidencia generada en todos los ensayos clínicos, de los fundamentos de la toma de decisiones y de las recomendaciones de los comités asesores en relación a los conflictos de intereses percibidos.
- Que los ensayos clínicos tengan la suficiente potencia para asegurar la seguridad y la eficacia. La fase III de esos ensayos puede no detectar efectos adversos infrecuentes (tasa comprendida entre ≥ 0.01% y < 0.1%) pero sí graves cuando son pocos los participantes en los mismos. Para identificar los efectos adversos infrecuentes o muy infrecuentes es importante que los ensayos cuenten con un alto número de participantes (por ejemplo, la invaginación intestinal asociada al Rotashield).
- Disponer de sistemas de monitorización postcomercialización y de vigilancia activa al objeto de detectar efectos adversos infrecuentes pero graves y para detectar los fallos de vacunación.
- Medir objetivos de mayor calidad. Favorecer la prevención de la enfermedad respecto de los subrogados (por ejemplo, serológicos).
- La fase III de los ensayos se llevará a cabo en lugares donde sea prevalente la enfermedad para que garantizar exposición a la enfermedad y poder determinar la cuantía de la prevención.
- Cuando no haya tratamientos para COVID-19, se consideran no éticos los ensayos de provocación en humanos.
- Representación igualitaria de las comunidades en riesgo de padecer enfermedad grave que estén infrarrepresentadas, por ejemplo, personas mayores, grupos raciales o étnicos, embarazadas e inmunodeprimidos.
Referencias
- Dixon, J.R. The International Conference on Harmonization Good Clinical Practice guideline. Quality Assurance 1998; 6(2):65-74. doi: 10.1080/105294199277860.
- Graham, J.E, Borda-Rodrigeuz, A., Huzair, F., & Zinck, E. Capacity for a global vaccine safety system: The perspective of national regulatory authorities. Vaccine, 2012; 30(33), 4953-4959. doi:10.1016/j.vaccine.2012 .05.045.
- Harmon, S.H.E., Faour, D.E., MacDonald, N.E., Graham, J.E., Steffen C., Henaff L, Shendale S., the Global NITAG Network Survey Correspondents. Immunization governance: Mandatory immunization in 28 Global NITAG Network countries. Vaccine https://doi.org/10.1016/j.vaccine.2020.09.053
- Morten C.J., Kapczynski A, Krumholz HM, Ross, J.S. To help develop the safest, most effective coronavirus tests, treatments, and vaccines, ensure public access to clinical research data. Health Affairs Blog, March 26, 2020. https://www.healthaffairs.org/do/10.1377/hblog20200326.869114/full/
- Herder, Matthew and Janice E. Graham. Opinion: Herder and Graham: Canadians need and deserve transparency on COVID-19 vaccines. Ottawa Citizen Sept 15, 2020. https://ottawacitizen.com/opinion/herder-and-graham-canadians-need-and-deserve-transparency-on-covid-19-vaccines
- Graham, J.E. Smart Regulation: Will the government’s strategy work? Canadian Medical Association Journal 2005;173(12),1469-1470. doi: 10.1503/cmaj.050424. Retrieved from https://www.cmaj.ca/content/173/12/1469.short
- Graham, J.E., & Nuttall, R. Faster Access to New Drugs: Fault Lines Between Health Canada’s Regulatory Intent and Industry Innovation Practices. Ethics in Biology, Engineering & Medicine – An International Journal 2013;4(3),231-239. doi: 10.1615/EthicsBiologyEngMed.2014010771. (http://hdl.handle.net/10222/75934)
- Doshi, P. Pandemrix vaccine: why was the public not told of early warning signs? BMJ 2018;362:k3948 doi: 10.1136/bmj.k3948.
- GAVI. Can vaccine clinical trials be sped up safely for COVID-19? https://www.gavi.org/vaccineswork/how-covid-19-leading-innovation-clinical-trials
¿Por qué se interrumpieron los ensayos clínicos de la vacuna de Oxford y cómo se determinó su seguridad?
Hanna Nohynek y el Equipo de Preguntas y Respuestas
Un participante en el estudio desarrolló debilidad en brazos y piernas después de la vacunación y se diagnosticó de mielitis transversa -síndrome inflamatorio que afecta a la médula espinal-. En una evaluación posterior se detectó que otro participante había sido diagnosticado de esclerosis múltiple que se consideró no relacionada con la vacuna frente a COVID-191. En ensayos clínicos con miles de participantes no son infrecuentes estas interrupciones. Las patologías pueden ocurrir por azar pero aun así deben ser evaluadas por personas independientes para poder clarificar si están relacionadas o no con la medicina o con la vacuna estudiada. En el caso concreto de la vacuna de Oxford, los expertos independientes llegaron a la conclusión que la vacuna no era la causante de esas patologías, por lo que se permitió que continuara el estudio reclutando voluntarios del Reino Unido, Sudáfrica, Brasil, Japón y los Estados Unidos.
Referencias
- AstraZeneca and J&J get go-ahead to resume Covid-19 vaccine trials. Accessed on October 26, 2020 at https://www.ft.com/content/2d2d0e8c-3560-456f-bf3e-59a869e6aa00
Introducción de las vacunas en países
Papel crítico de los sanitarios de primera línea en el conocimiento de la efectividad y seguridad de una vacuna ya aprobada
Noni E MacDonald y el Equipo de Preguntas y Respuestas
Los ensayos clínicos de fase IV (vigilancia postcomercialización) de las vacunas COVID-19 que muchas autoridades regulatorias nacionales (NRA) exigen para poder aprobar una vacuna no son, a veces, lo suficientemente extensos para detectar fallos de vacunación o efectos adversos muy infrecuentes atribuibles a las vacunas.
Las contribuciones clave de los sanitarios de primera línea a la hora de determinar la efectividad de las vacunas y su seguridad, incluyen:
A) Detección de los fallos de vacunación
En la fase III de los ensayos clínicos se obtienen datos de eficacia, por ejemplo, casos de COVID-19 en vacunados versus casos en no vacunados, pero esos estudios no proporcionan datos de cómo se comportan en el “mundo real”, esto es, la efectividad. La efectividad de una vacuna puede verse influenciada por muchos factores del tipo de la edad, patologías de base, contexto, género, medicación, estado nutricional y adherencia estricta de los programas de vacunación al almacenamiento y transporte, entre otros. De ahí que una vez aprobada la vacuna COVID-19, necesitamos conocer lo bien que se comporta en el mundo real en el que hay que vacunar a mucha gente para protegerles a ellos y a su comunidad.
En cualquier país en el que se esté utilizando la vacuna los sanitarios necesitan chequear a todos los pacientes que presenten cuadros clínicos sugestivos de infección por COVID-19 para determinar si habían recibido previamente la vacuna y en ese caso, el número de dosis y cuando recibió cada una de ellas. Esto puede llevarse a cabo consultando los registros nacionales de vacunación, si es que existen, la historia clínica del paciente o preguntándole directamente. Si el paciente fue vacunado, debe verificarse el diagnóstico de infección por COVID-19 pero no en base a la clínica sino mediante la prueba “gold-standard” que es la reacción en cadena de la polimerasa en tiempo real (RT-PCR) a realizar en las secreciones respiratorias en la primera semana tras el comienzo de los síntomas1,2. Pueden utilizarse también los test rápidos pero es preferible la RT- PCR al objeto de minimizar el riesgo de un falso positivo, tal como ha expresado la Food and Drug Administration de los Estados Unidos (https://www.fda.gov/medical-devices/letters-health-care-providers/potential-false-positive-results-antigen-tests-rapid-detection-sars-cov-2-letter-clinical-laboratory). Para las vacunas COVID-19 que utilizan como antígeno la proteína “espícula” no son útiles en los vacunados la realización de los tests serológicos rutinarios para confirmar el diagnóstico. Se necesitaría el test de anticuerpos frente a nucleocápside. Además de proporcionar los cuidados pertinentes al paciente, los sanitarios tienen que reportar a Salud Pública los casos sospechosos de fallos de vacunación para que se lleven a cabo las preceptivas investigaciones y el seguimiento para determinar si realmente se trata de un fallo de vacunación y, en su caso, el porqué. A la hora de determinar la efectividad de la vacuna implicada son importantes los detalles siguientes:
- ¿El fallo se debe concretamente a una vacuna específica y/o fue un error programático de almacenamiento, manejo, del uso de disolventes o de otro tipo?, ¿dónde se produjo?
- ¿Tenía el paciente alguna enfermedad preexistente que pudiera haber alterado la respuesta a una vacuna en concreto?
- ¿Se han observado esos fallos en otras personas que también han recibido esa vacuna en el mismo periodo de tiempo o que pertenecen al mismo subgrupo de población?, ¿en nuestro país?, ¿en el suyo o en otros países?
- ¿Hay evidencias de que mengue la protección con el tiempo?, ¿varía con la edad, por subgrupos de población o por otros factores?
Una vez que vayan aumentando los casos de fallos de vacunación se podrán observar las diferencias en la efectividad de algunas vacunas en relación a las distintas edades, subgrupos y entornos. Esta información tiene importancia a escala local, nacional y mundial. Según que hallazgos se encuentren se pueden hacer modificaciones a las recomendaciones de uso de la vacuna, bien por grupos de edad y/o por subgrupos -mayor número de dosis, distintos intervalos entre ellas, necesidad de recibir dosis de recuerdo, etc., o para ofrecer consejos específicos sobre el intervalo entre que se recibe una vacuna y el momento de la protección.
B) Detección de efectos adversos muy infrecuentes pero graves (AEFI)
La evaluación de la seguridad de una vacuna nueva es un proceso complicado3. Pueden aparecer las preocupaciones acerca de la aceptación de una vacuna por parte del individuo o de la comunidad cuando aparece en los medios la noticia de un AEFI y las autoridades o los expertos no ofrecen la suficiente información sobre ese acontecimiento y sobre los pasos que se van a adoptar para comprender mejor si ha existido causalidad.
Se puede de finir un AEFI como “la aparición de un elemento médico perjudicial posterior a una inmunización y que no necesariamente tiene una relación causal con el uso de esa vacuna”4. Un efecto adverso grave es aquel que aboca a una situación que pone en peligro la vida o a la muerte, a la hospitalización, a una discapacidad significativa o a una anomalía congénita4. No obstante, el mero hecho de que haya ocurrido un AEFI no significa que esté causalmente relacionado con la vacuna, son el proceso de fabricación, con el programa de vacunación o con el mismo procedimiento de vacunación, ya que podría tratarse de una coincidencia o de un evento no relacionado.
Los ensayos clínicos previos a la comercialización son capaces de detectar AEFI frecuentes que son los que aparecen en el 1% a 10% de los vacunados y son del tipo de dolor en el brazo, enrojecimiento local, febrícula, etc. Al ser leves y autolimitados no impiden la aprobación de una vacuna siempre y cuando su frecuencia no sea excesiva. Es tranquilizador que en las fases I a III de los ensayos clínicos de una de las vacunas de ARNm y de otra de vector vírico de adenovirus próxima a aprobarse en varios países no se ha reportado ningún efecto adverso grave a la vista de lo publicado en revistas revisadas por pares5,6. Los efectos adversos más frecuentes de una vacuna de ARNm incluyeron dolor leve a moderado en el lugar de la inyección, fatiga y febrícula7.
El número de participantes en estas fase previas a la aprobación, aunque con 30.000 o más participantes, aun no es suficiente para detectar los efectos adversos muy infrecuentes que aparecen con una frecuencia inferior a 0.01%. Los sanitarios deben recordar que en el caso de las vacunas COVID-19, los efectos adversos graves pero muy infrecuentes siempre serán menos frecuentes que los efectos graves de la propia enfermedad COVID-19, como sus complicaciones, hospitalizaciones e incluso la muerte8,9.10. Los AEFI infrecuentes y graves solo se detectarán cuando se hayan vacunado millones de personas, aunque según el país puede haber una amplia variación en cuanto a la capacidad de llevar a cabo la vigilancia de los mismos (https://www.who.int/vaccine_safety/publications/2019_Landscape_Analysis.pdf?ua=1).
Independientemente de si solo existe un sistema pasivo de vigilancia de los AEFI o de que haya uno activo para detectar señales sobre la seguridad11, los sanitarios de primera línea juegan un papel clave a la hora de detectar casos graves y de alertar a Salud Pública. Estos trabajadores no solo tienen que conocer como reportar un AEFI grave en su entorno sino también tienen que conocer que no se puede concluir que una vacuna ha sido la causante. Esa decisión la tiene que tomar el comité evaluador de la causalidad de cada país (https://www.who.int/vaccine_safety/publications/CausalityAssessmentAEFI_EN.pdf?ua=1).
Esos comités determinan, utilizando procesos de revisión sistemática de casos, si el acontecimiento reportado (un diagnóstico específico) se debió a la vacuna, a un error de fabricación, a un error programático, a uno del propio programa de vacunación, a una respuesta relacionada con stress vacunal o fue una mera coincidencia. La Organización Mundial de la Salud ha desarrollado manual de vigilancia de la seguridad de vacunas COVID-19 para ayudar a los países que llevan a cabo esta importante tarea. (https://www.who.int/vaccine_safety/committee/Module_Establishing_surveillance_systems.pdf?ua=1). Los sanitarios de primera línea, más allá de reportar un AEFI grave, tienen también, a menudo, una relación con el paciente y con su familia y son excelentes candidatos para comunicar los pasos que se van a adoptar para asegurarse de si la vacuna jugó o no un papel en la aparición de ese efecto adverso grave. Hay que resaltar la importancia de no llegar prematuramente a conclusiones. Salud Pública y el programa de vacunación precisan trabajar codo con codo con los sanitarios de primera línea para asegurar una comunicación fluida mientras se esté investigando el AEFI grave y la evaluación de la causalidad12.
Es esencial la formación, la potenciación y el apoyo a los sanitarios por parte de los programas de vacunación de sus países para detectar y reportar los casos sospechosos de fallos de vacunación y de los AEFI graves. Suponen un elemento capital para dar a conocer la efectividad y la seguridad de las vacunas COVID-19 una vez comercializadas. Cada país necesita compartir sus conocimientos para conocer a escala global la efectividad de las distintas vacunas COVID-19 y en diferentes entornos. Los efectos adversos graves evaluados por los comités ad hoc y que se consideran asociados a la vacuna, a su fabricación, a un error programático o a una respuesta relacionada con stress vacunal13 deben ser reportados al Uppsala Monitoring Centre que es parte de la International Drug Monitoring de la Organización Mundial de la Salud (https://www.who-umc.org/).
Referencias
- The estimation of diagnostic accuracy of tests for COVID-19:A scoping review. Axell-House DB, Lavingia R, Rafferty M, ClarkE, Amirian ES, Chiao EY. 2020, Journal of Infection, Vol. 81, pp. 681-697.
- Considerations for diagnostic COVID-19 tests. Vandenberg O, Martiny D, Rochas O et al. October 14, 2020, Nat Rev Microbiol.
- Assessing the Safety of COVID 19 Vaccines: A Primer. H, Petousis Harris. 2020, Drug Safety, Vol. 43, pp. 1205-1210.
- World Health Organization. Causality Assessment of an Adverse Event Following Immunizaiton (AEFI) user manual for the revised WHP classification. Geneva : World Health Organization, 2018.
- Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Moreira ED, Zerbini C, Bailey R, Swanson KA, Roychoudhury S, Koury K, Li P, Kalina WV, Cooper D, Frenck RW Jr, Hammitt LL, Türeci Ö, Nell H, Schaefer A, Ünal S, et. December 10, 2020, N Engl J Med.
- Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, Angus B, Baillie VL, Barnabas SL, Bhorat QE, Bibi S, Briner C, Cicconi P, Collins AM, Colin-Jones R, Cutland CL, Darton TC, Dheda K, Duncan CJA, Emary KRW, Ewer KJ, Fairlie L, et al. Dec 8, 2020, Lancet, pp. S0140-6736(20)32661-1.
- Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. Walsh EE, Frenck RW Jr, Falsey AR, Kitchin N, Absalon J, Gurtman A, Lockhart S, Neuzil K, Mulligan MJ, Bailey R, Swanson KA, Li P, Koury K, Kalina W, Cooper D, Fontes-Garfias C, Shi PY, Türeci Ö, Tompkins KR, Lyke KE, Raabe V, Dormitzer PR, Jansen KU,etal. Oct 14, 2020, N Engl J Med.
- Three-month Follow-up Study of Survivors of Coronavirus Disease 2019 after Discharge. Liang L, Yang B, Jiang N, Fu W, He X, Zhou Y, Ma WL, Wang X. 47, 2020, J Korean Med Sci, Vol. 35, p. e418.
- Price-Haywood EG, Hospitalization and Mortality among Black Patients and White Patients with Covid-19. Price-Haywood EG, Burton J, Fort D, Seoane L. 26, 2020, N Engl J Med., Vol. 382, pp. 2534-2543.
- Prevalence and predictors of death and severe disease in patients hospitalized due to COVID-19: A comprehensive systematic review and meta-analysis of 77 studies and 38,000 patients. Dorjee K, Kim H, Bonomo E, Dolma R. 12, 2020, PLoS One, Vol. 15, p. e0243191.
- Optimizing safety surveillance for COVID-19 vaccines. RE, Chandler. 8, 2020, Nature reviews. Immunology, Vol. 20, pp. 451-2.
- Lessons on causality assessment and communications from the 2019 South-East Asia Regional (SEAR) workshop on inter-country expert review of selected Adverse Events Following Immunization (AEFI) cases. MacDonald NE, Guichard S, Arora N, Menning L, Wilhelm E,2019 Inter-country SEAR Workshop Participants, Communication Experts. 32, 2020, Vaccine, Vol. 38, pp. 4924-4932.
- Immunization stress-related response – Redefining immunization anxiety-related reaction as an adverse event following immunization. Gold MS, MacDonald NE, McMurtry MC, Balakrishnan MR, Heininger U, Menning L, Benes O, Pless R, Zuber PLF. 14, 2020, Vaccine, Vol. 38, pp. 3015-3020.
Al hablar de la vacunación de la población altamente prioritaria, ¿qué queremos decir con la evaluación del riesgo y beneficio?
Sonali Kochhar y el Equipo de Preguntas y Respuestas
La vacunación es una de las intervenciones más exitosas en Salud Pública en términos de prevención de la enfermedad1. Las vacunas se administran a personas sanas entre las que se incluyen niños y personas vulnerables, por lo que es muy bajo el nivel aceptable de riesgo atribuible a la vacuna. Es por tanto esencial que tengan un balance favorable riesgo-beneficio. Ello quiere decir que los beneficios de la vacunación deben ser significativamente superiores comparados con cualquier riesgo de daño, con lo que se asegura desde la Salud Pública un proceso de decisión apropiado e informado2.
El perfil riesgo-beneficio es la base de la decisión de las autoridades regulatorias para todas las vacunas y fármacos durante los procesos de revisión pre y postcomercialización2,3. La autorización de una vacuna o de un fármaco solo se garantiza si la evaluación del riesgo y del beneficio muestra un balance suficientemente positivo en base a la evidencia científica disponible3.
Esa evaluación puede que sea distinta según poblaciones específicas (por ejemplo, en niños, embarazadas o personas inmunodeprimidas) y para personas de alto versus bajo riesgo de padecer una enfermedad (por ejemplo, vivir en un área en la que hay un brote activo)3.
La evaluación toma en consideración un número de factores que incluyen la gravedad de la enfermedad, si se dispone de medicinas que satisfagan las necesidades médicas de la población, la efectividad de la vacuna a la hora de evitar la enfermedad en ciertas poblaciones, y el riesgo de efectos adversos tras la vacunación en esas mismas poblaciones al comparar con los riesgos inherentes al padecimiento de la enfermedad2,3,4.
Si tomamos como ejemplo la vacuna frente al sarampión, el beneficio sobrepasa con creces a los riesgos (hay que comparar el riesgo de efectos adversos postvacunación con los asociados a la enfermedad. También se deben tener en cuenta los riesgos de los tratamientos utilizados para aliviar los síntomas de la enfermedad5.
Evaluación del riesgo-beneficio de la vacuna frente al sarampión5
(El riesgo de efectos adversos debe compararse con el riesgo asociado a la enfermedad y al riesgo de los efectos adversos del tratamiento utilizados para aliviar los síntomas de la enfermedad)


Referencias
- Rémy V, Zöllner Y, Heckmann U. Vaccination: the cornerstone of an efficient healthcare system. J Mark Access Health Policy. 2015;3:10.3402/jmahp.v3.27041. doi:10.3402/jmahp.v3.27041
- Arlegui, H., Bollaerts, K., Salvo, F. et al. Benefit–Risk Assessment of Vaccines. Part I: A Systematic Review to Identify and Describe Studies About Quantitative Benefit–Risk Models Applied to Vaccines. Drug Saf (2020). https://doi.org/10.1007/s40264-020-00984-7
- Benefit-risk assessment in drug regulatory decision-making. Draft PDUFA VI Implementation Plan (FY 2018-2022). FDA. March 30, 2018. Accessed on Sept 30, 2020 at https://www.fda.gov/media/112570/download
- Curtin F, Schulz P. Assessing the benefit: risk ratio of a drug--randomized and naturalistic evidence. Dialogues Clin Neurosci. 2011;13(2):183-90. PMID: 21842615; PMCID: PMC3181998.
- Risk scales : benefits of vaccines far outweigh the risks. WHO Europe. Accessed on Oct 9, 2020 at https://www.euro.who.int/en/health-topics/disease-prevention/vaccines-and-immunization/publications/2017/risk-scales-benefits-of-vaccines-far-outweigh-the-risks-2017
¿Cuáles son los efectos adversos más frecuentes que esperamos tras vacunar?
Youngmee Jee y el Equipo de Preguntas y Respuestas
Los efectos adversos relacionados con la vacunación son cualquier problema de salud que los estudios hayan demostrado que están causados por la misma. Por otra parte, los efectos adversos son cualquier problema de salud que aparece tras la vacunación que puede ser coincidente o relacionado con la vacuna.
Los efectos adversos relacionados con la vacunación son cualquier problema de salud que los estudios hayan demostrado que están causados por la misma. Por otra parte, los efectos adversos son cualquier problema de salud que aparece tras la vacunación que puede ser coincidente o relacionado con la vacuna.
- El dolor en el lugar de la inyección y el enrojecimiento e hinchazón son efectos adversos menores frecuentes. La febrícula, fatiga, dolor de cabeza y algo de dolor muscular o articular también son menores pero frecuentes. En general, aparecen a las pocas horas tras la inyección pero desaparecen en pocos días.
- Los efectos adversos graves del tipo de convulsiones, trombopenia y el llanto prolongado pueden aparecer, aunque con baja frecuencia, y no suelen abocar a problemas a largo plazo1.
- Son muy infrecuentes las reacciones alérgicas del tipo de anafilaxia que aparecen inmediatamente (generalmente en unos minutos) tras la vacunación (por ejemplo, debidas a algún componente como la neomicina) y pueden poner la vida en peligro. Los sanitarios deberían estar preparados para tratar los síntomas de la anafilaxia1.
- Los efectos adversos de las vacunas se pueden clasificar en 5 categorías:
- Reacción relacionada con la propia vacuna,
- Reacción relacionada con la calidad de la vacuna,
- Reacción relacionada con un error de vacunación,
- Reacción relacionada con stress vacunal, y
- Acontecimiento coincidente1
- Los efectos adversos tras la vacunación se consideran graves si acaban en muerte, comprometen la vida, precisan o prolongan la hospitalización, producen una discapacidad persistente o importante, se trata de una anomalía o defecto de nacimiento o que precisa de una intervención para evitar daños. Las tasas esperadas de efectos adversos tras la administración de algunas vacunas se encuentran disponibles en https://vaccine-safety-training.org/1
- Los datos generados en la fase III de los ensayos clínicos de la vacuna frente a COVID-19 de Pfizer2 han mostrado que produce efectos adversos frecuentes del tipo de dolor de cabeza, escalofríos, dolor articular y diarrea que fueron menos frecuentes en las personas mayores que en los más jóvenes. La mayoría de ellos aparecieron tras la segunda dosis y fueron leves o moderados. Todos los datos serán estudiados cuidadosamente por los reguladores a la hora de tomar una decisión sobre la autorización o no del uso de una vacuna.
- El reporte de seguridad3 de la vacuna de Moderna ha reportado, también, efectos adversos menores. A tener en cuenta que los efectos generales fueron más frecuentes tras recibir la segunda dosis y en aquellos que recibieron dosis más altas de vacuna.
- Las vacunas COVID-19 han finalizado la fase 3 de los ensayos clínicos una vez administradas a 20.000 o más personas, habiéndose detectado muy pocos o ningún efecto adverso grave. También han mostrado ser eficaces por lo que es.4
Tabla 1. Reacciones frecuentes y menores y su tratamiento
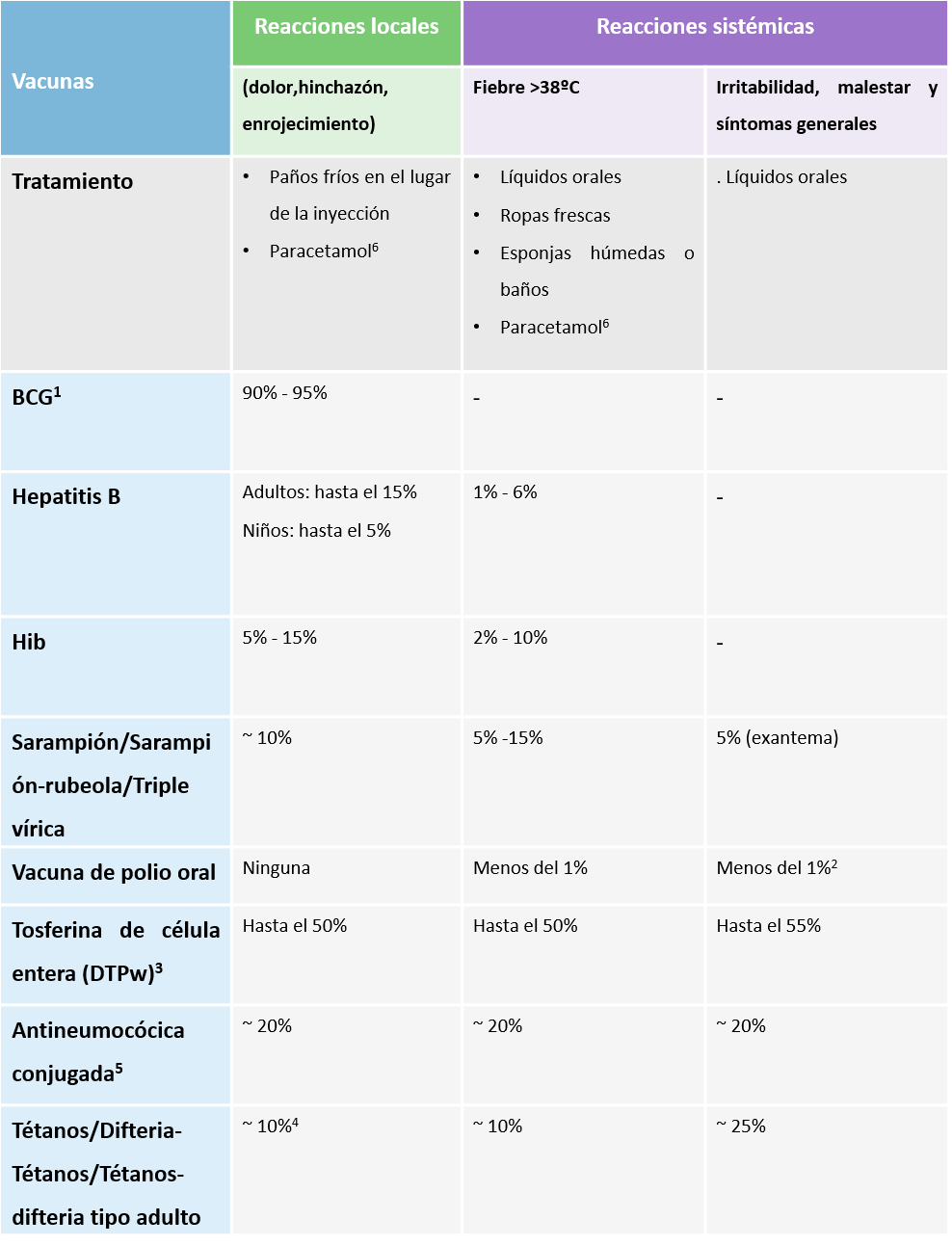
1. Local reactogenicity varies from one vaccine brand to another, depending on the strain and the number of viable antigen in the vaccine.
2. Diarrhoea, headache and/or muscle pains.
3. When compared with whole cell pertussis (DTwP) vaccine, acellular pertussis (DTaP) vaccine rates are lower.
4. Rate of local reactions are likely to increase with booster doses, up to 50 – 85%.
5. Source: http://www.cdc.gov/vaccines/hcp/acip-recs/
6. Paracetamol dose: up to 15mg/kg every 6–8 hours, maximum of 4 doses in 24 hours.
Source: WHO Vaccine safety basics e-learning course (module 3: Adverse events following immunization)
Referencias
-
WHO vaccine safety basics e-learning course. Accessed on 18 Oct 2020 at https://vaccine-safety-training.org/
-
Pfizer says Covid-19 vaccine showed moderate side effects. Accessed on
https://www.clinicaltrialsarena.com/news/pfizer-covid-vaccine-tolerability-data/ -
Anderson EJ, Rouphael NG, Widge AT, Jackson LA, Roberts PC et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. N Engl J Med. 2020 Sep 29. doi: 10.1056/NEJMoa2028436.
-
Grech V, Calleja N. Theoretical novel COVID-19 vaccination risk of rare and severe adverse events versus COVID-19 mortality. Early Hum Dev. 2020 Oct 1:105212. doi: 10.1016/j.earlhumdev.2020.105212.
¿Qué medidas se adoptarán si un vacunado experimenta un efecto adverso?
Noni MacDonald y el Panel de Preguntas y Respuestas
Los efectos colaterales se llaman efectos adversos y los que aparecen después de la vacunación se llaman Efectos Adversos Tras la Vacunación (AEFI).
"Cualquier incidencia médica tras la vacunación y que no necesariamente tiene una relación causal con el uso de la vacuna. El acontecimiento adverso puede ser cualquier signo no deseado o desfavorable, un hallazgo de laboratorio anormal o síntomas o enfermedad."1
En general, en menos de 20% de los vacunados y a las pocas horas de recibir la vacuna, aparecen efectos adversos (AEFI) menores que incluyen síntomas y signos del tipo de febrícula, dolor muscular, dolor de cuerpo, dolor local, enrojecimiento y/o hinchazón en el lugar de la inyección. Suelen resolverse en poco tiempo y no tienen consecuencias en el largo plazo. Cuando se trata de una vacuna nueva, se presta especial atención a determinar si los efectos adversos menores aparecen con una frecuencia similar a la que se detectó en los ensayos clínicos y, si son más frecuentes en distintos grupos de edad o en aquellos con enfermedades de base, información ésta que puede que no se haya obtenido en los ensayos clínicos.
La intensidad de los efectos adversos (AEFI) será, en general, leve y muy infrecuentemente serían de intensidad moderada o grave (fiebre). Los AEFI graves no necesariamente generan problemas a largo plazo1.
Los que precisan de especial y rápida atención son los graves.
"Un efecto adverso grave (AEFI) es el que acaba en muerte, pone en peligro la vida, requiere ingreso hospitalario o una prolongación de la hospitalización, provoca una discapacidad permanente o significativa, es una anomalía o defecto congénito o precisa de actuaciones para evitar una incapacidad o un daño permanente.1"
Los efectos adversos graves no se detectan, en general, en los ensayos clínicos ya que suelen ser muy infrecuentes -ocurren en menos de 1 por cada 10.000 vacunados-. El aspecto crítico con ellos es el determinar si se debe a la propia vacuna, por ejemplo, una reacción relacionada con la propia vacuna; se trata de una reacción por defecto de calidad de la misma, por ejemplo, un problema en la fabricación; es un error programático; una reacción relacionada con el acto vacunal, por ejemplo, un almacenamiento inapropiado, un disolvente incorrecto, etc….; una reacción por stress, por ejemplo, un acontecimiento coincidente1,2.
A menudo los efectos adversos son coincidencias. Considera si el AEFI grave es debido a una acción correctora, por ejemplo, puede tratarse de una retirada de la vacuna. No obstante, rara vez el problema es atribuible a la propia vacuna debido al rigor en el proceso de aprobación de la vacuna y a la alta calidad de la fabricación.
Los sanitarios juegan un papel importante en relación a los AEFI:
a) Reconocen y reportan los AEFI graves y los menores si así se lo solicitan.
b) Proporcionan la atención necesaria a los pacientes que los sufren.
c) Ayudan a recopilar la información necesaria que necesitará el Comité de Evaluación de la Causalidad (Causality Assessment Committee) para determinar si hay una relación causal.
d) Mantienen la objetividad en el proceso de llegar a cualquier conclusión de causalidad3.
e) Comunican de una manera efectiva, en su momento y respetuosamente, apoyándose en lo que se conoce del acontecimiento. El programa local de Salud Pública debe también estar preparado para comunicar sobre lo acontecido y sobre los pasos que se han llevado a cabo para investigar en orden de establecer la causalidad3,4. Hay que trabajar conjuntamente con ellos y con vuestra institución para asegurar que se proporciona una información precisa. Cerciórate de que la información se valida y no se perpetuan las desinformaciones.
Referencias
-
World Health Organization. Vaccine Safety Basics e-learning course. Module 3. Adverse events following immunization. https://vaccine-safety-training.org/vaccine-reactions.html. Accessed Sept 24,2020
-
Gold MS, MacDonald NE, McMurtry CM, Balakrishnan MR, Heininger U, Menning L, Benes O, Pless R, Zuber PLF. Immunization stress-related response - Redefining immunization anxiety-related reaction as an adverse event following immunization. Vaccine. 2020; 38(14):3015-3020.
-
World Health Organization. Vaccine Safety Basics e learning course. Module 4: Surveillance. Causality Assessment of AEFIs. https://vaccine-safety-training.org/causality-assessment-of-aefis.html. Assessed Sept 24, 2020
-
World Health Organization EUROPE. Crisis Communication Template (2017). https://www.euro.who.int/en/health-topics/disease-prevention/vaccines-and-immunization/publications/2017/crisis-communications-plan-template-2017. Accessed Sept 24, 2020
Efectos de las vacunas en el largo plazo
¿Como conoceremos en el largo plazo que las vacunas son seguras?
Karina Top y el Equipo de Preguntas y Respuestas
Para todas las vacunas aprobadas por las agencias regulatorias nacionales (F.D.A. en los Estados Unidos o Health Canada) se monitoriza su seguridad y efectividad una vez introducidas en la población. Como mínimo, se recomienda a los países que implanten sistemas de vigilancia pasiva que puedan recopilar los informes de efectos adversos postvacunación que hayan sido reportados por los sanitarios, los fabricantes de vacunas y a veces por los mismos ciudadanos1. Estos informes se agrupan y analizan para identificar cualquier patrón que pudiera sugerir un problema con la seguridad de una vacuna (por ejemplo, cuando la frecuencia de la patología reportada es superior a la tasa basal encontrada en la población).
Se recomienda también que aquellos países que tengan la capacidad de implantar de sistemas activos de vigilancia que localicen los casos de efectos adversos postvacunación de especial importancia (por ejemplo, convulsiones, síndrome de Guillain-Barré) y que puedan comparar las tasas de esos casos entre vacunados y no vacunados para determinar si los efectos adversos se deben al azar (que es lo más habitual) o están relacionados con la vacuna.
Referencias
-
Department of Immunization, Vaccines and Biologicals. 2012. Global Vaccine Safety Blueprint. Geneva: World Health Organization. Access at: https://www.who.int/vaccine_safety/publications/en/. Accessed: 5 October 2020.
-
2020. Global Advisory Committee on Vaccine Safety, 27-28 May 2020. Wkly Epidemiol Rec. 95:325-336. Access at: https://apps.who.int/iris/bitstream/handle/10665/333136/WER9528-eng-fre.pdf?ua=1. Accessed: 5 October 2020.
